Um guia prático para navegar no Anexo 1 das BPF revisadas da UE
Por Ryan Murray, M.Sc., e Amanda McFarland, M.Sc., ValSource, Inc.

Ao longo dos últimos anos, várias revisões do Anexo 1 1 da UE foram lançadas e analisadas por inúmeros especialistas no assunto em todo o nosso setor. A versão final já está publicada e é hora de agir.
Navegar pelas mudanças no Anexo 1 pode parecer mais uma exploração da janela Johari. A janela Johari 2 lança luz sobre o conceito de conhecidos conhecidos, desconhecidos conhecidos e desconhecidos desconhecidos e foi adotado por muitas indústrias para identificar pontos cegos no que sabemos e não sabemos ao analisar dados. Se a intenção abrangente do Anexo 1 é trazer medicamentos seguros e eficazes para o mundo, entender como se alinhar com o anexo e desenvolver uma estrutura para minimizar a incerteza reduzirá nosso prazo para conformidade. Dentro da estrutura da janela Johari, existem quatro categorias de informações:
- conhecidos conhecidos: os riscos dos quais sua organização está ciente
- desconhecidos conhecidos: riscos que você conhece, mas que não são totalmente compreendidos e podem ser investigados
- conhecidos desconhecidos: aqueles riscos que você ainda não descobriu
- desconhecidos desconhecidos: aqueles riscos que você não sabe que não conhece.
A Figura 1 3 ilustra a relação entre os tipos de informações que serão encontradas e como esse conhecimento pode nos levar à conformidade.
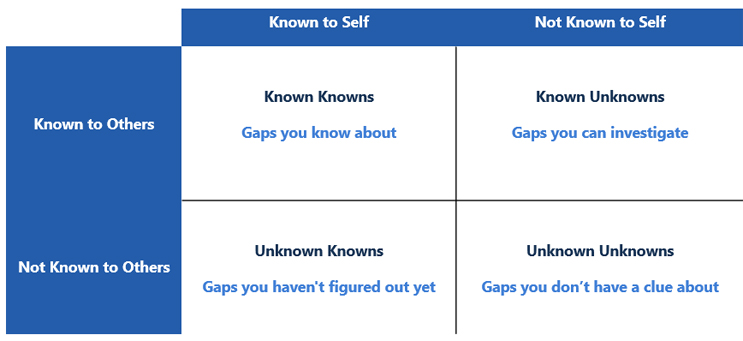
Figura 1: Janela Johari Adaptada para a Avaliação de Lacunas do Anexo 1. Adaptado de Risk Intelligence: How to Live with Uncertainty, D. Evans, 2013
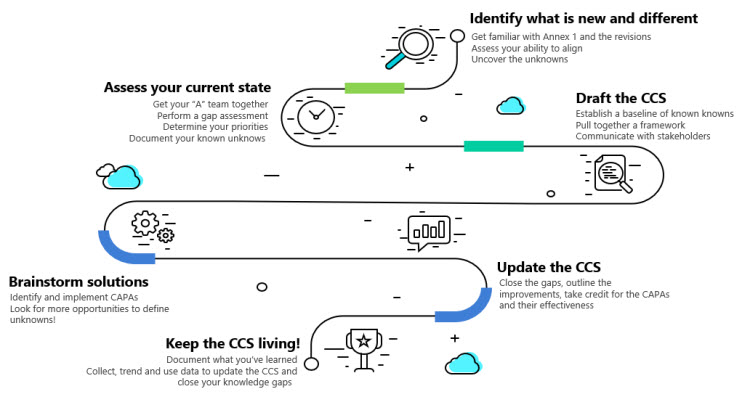
Este roteiro do Anexo 1 usará a Janela Johari como um guia para descobrir informações para demonstrar o aumento do conhecimento e compreensão de seus produtos enquanto soluciona os desafios de conformidade. A Figura 2 descreve os fundamentos do roteiro.
Figura 2: Roteiro do Anexo 1. Clique na imagem para ampliá-la.
Identifique o que é novo e diferente: descubra o desconhecido
Passo 1: Conheça o Anexo 1
O primeiro passo para desenvolver uma estratégia sólida para avaliar o impacto das revisões do Anexo 1 em sua organização é garantir que as mudanças no anexo sejam bem compreendidas e esclarecer as incógnitas. Uma das principais diferenças que existem na revisão do Anexo 1 é relativa à inclusão do Gerenciamento de Risco de Qualidade (QRM). Nas versões anteriores do Anexo 1, as referências à gestão de riscos de qualidade eram limitadas. Agora, a necessidade de gerenciamento de risco e princípios de risco são vistos como fundamentais e totalmente incorporados. Os princípios QRM fornecem um meio proativo de identificar, avaliar cientificamente e controlar os riscos potenciais para a qualidade do produto. A execução do gerenciamento de risco e a aplicação dos princípios de risco vem em uma variedade de aplicações, incluindo a ciência e avaliações de risco baseadas em evidências e abordagens multidimensionais para a tomada de decisões, bem como o reconhecimento e exploração da incerteza. A necessidade de QRM é mais notável em relação à estratégia de controle de contaminação (CCS). A estratégia de controle de contaminação pretende ser um documento único que serve como ponto de referência para todos os pontos críticos de controle e demonstra como um estado de controle é cientificamente estabelecido, mantido e permanece efetivo. O CCS destina-se a vincular os corpos de conhecimento contidos nas avaliações de risco que ajudaram a informar os controles de processo para proteger a qualidade do produto e a segurança do paciente. A necessidade de QRM é mais notável em relação à estratégia de controle de contaminação (CCS). A estratégia de controle de contaminação pretende ser um documento único que serve como ponto de referência para todos os pontos críticos de controle e demonstra como um estado de controle é cientificamente estabelecido, mantido e permanece efetivo. O CCS destina-se a vincular os corpos de conhecimento contidos nas avaliações de risco que ajudaram a informar os controles de processo para proteger a qualidade do produto e a segurança do paciente. A necessidade de QRM é mais notável em relação à estratégia de controle de contaminação (CCS). A estratégia de controle de contaminação pretende ser um documento único que serve como ponto de referência para todos os pontos críticos de controle e demonstra como um estado de controle é cientificamente estabelecido, mantido e permanece efetivo. O CCS destina-se a vincular os corpos de conhecimento contidos nas avaliações de risco que ajudaram a informar os controles de processo para proteger a qualidade do produto e a segurança do paciente.
Etapa 2: revise seu sistema de gerenciamento de qualidade (SGQ)
Com um firme entendimento das mudanças no Anexo 1 e da aplicabilidade aos seus processos, é hora de revisar o sistema de gestão da qualidade para garantir que ele tenha o nível apropriado de maturidade para dar suporte às atualizações do Anexo 1. Uma vez que existe uma dependência significativa de QRM e gestão do conhecimento (KM) para informar a estratégia de controle de contaminação, é importante entender a maturidade atual do programa de gestão de risco de qualidade. Embora o uso do gerenciamento de risco tenha sido bem estabelecido por meio de documentos de orientação, como ISO 31000 4 e ICH Q9, 5o nível de maturidade em relação ao gerenciamento de risco varia de acordo com o setor. Devido à intensidade das atividades de gestão de risco e gestão do conhecimento necessárias para informar o CCS, cada organização precisa entender a estrutura pela qual as avaliações de risco serão estabelecidas e mantidas. Inclusive da robustez necessária para apoiar os programas QRM e KM são as estruturas relacionadas ao pessoal e treinamento. Garantir que o programa tenha o nível adequado de suporte gerencial e pessoal para liderar as avaliações de risco é apenas um fator importante. Considerações adicionais incluem determinar quem será o proprietário das avaliações de risco e quem será responsável pela mitigação e manter as avaliações de risco atualizadas e refletindo o estado atual.
Incluir a maturidade do SGQ é o elemento de treinamento no local. As atividades de gerenciamento de risco necessárias para informar o CCS exigirão que o local tenha um grupo de indivíduos com conhecimento profundo dos princípios de risco, experiência com uma variedade de ferramentas de gerenciamento de risco e as habilidades necessárias para liderar atividades de risco complexas.
Avalie o estado atual: documente as incógnitas conhecidas
Etapa 3: estabeleça um líder e/ou equipe de CCS
A navegação na criação do CCS exigirá a contribuição de muitas facetas da organização e não se limita ao grupo de microbiologia do local. Em vez disso, para garantir uma colaboração bem-sucedida, um líder do CCS deve ser identificado e a participação nas avaliações deve ser multidisciplinar e incluir o gerenciamento do local. A liderança do CCS será o canal central entre cada uma das áreas funcionais fornecendo insumos para a estratégia de controle de contaminação e coordenando o esforço.
A natureza do CCS é complexa e abrangente. No entanto, com coordenação cuidadosa, a utilidade do documento permitirá que a organização forneça uma narrativa bem construída do estado de controle. Existem várias avaliações de risco fundamentais que serão incluídas no CCS relacionadas a avaliações de risco de processo, ambientais e de utilidades críticas e avaliações de risco de controle de processo asséptico. A estratégia de risco empregada e o escopo dessas avaliações de risco devem ser cuidadosamente considerados para garantir que minimizem a sobreposição de conteúdo. A equipe deve ser disciplinada tanto em aderir ao escopo definido quanto em garantir que a questão de risco definida seja totalmente abordada. Permanecer na tarefa em relação ao escopo e à estratégia resultará em várias eficiências, incluindo menos avaliações de risco para atualizar/revisar e manter,
Etapa 4: Conduzir a Avaliação de Lacunas do Anexo 1
Definir as diferenças entre as versões anteriores e revisadas do Anexo 1 fornecerá uma abordagem estruturada para identificação e análise de lacunas. Uma ferramenta de análise de lacunas deve explorar os requisitos do anexo tanto no nível microscópico (ou seja, linha por linha) quanto macroscópico (ou seja, quadro geral). Uma avaliação linha por linha garantirá que as mudanças na linguagem sejam bem compreendidas e que a interpretação dos requisitos esteja alinhada, enquanto a avaliação macroscópica fornecerá uma visão holística dos requisitos. Uma compreensão holística permitirá que a organização reflita sobre como cada elemento do Anexo 1 se reúne para ilustrar o ciclo de vida completo de um produto produzido assepticamente.
Etapa 5: determinar o esquema de priorização para correção de lacunas
Para garantir que as lacunas identificadas sejam caracterizadas adequadamente, considere adotar uma abordagem baseada em risco para determinar a gravidade da lacuna. Os domínios de risco a serem considerados incluem qualidade do produto, segurança do paciente e conformidade em função do risco relativo da lacuna identificada. A consideração dessas dimensões de impacto permitirá que a organização defina o plano de priorização e remediação de gaps. Ao desenvolver a lista priorizada, considere os esforços de remediação de curto e longo prazo. Por exemplo, se for identificada uma lacuna na instalação que será mitigada em dois anos usando a automação, é importante considerar como essa lacuna será abordada nesse ínterim.
Etapa 6: criar um CCS e comunicar os resultados da avaliação de lacunas com as partes interessadas
Uma vez que as lacunas tenham sido identificadas e totalmente compreendidas, os resultados da avaliação de lacunas devem ser compartilhados com todas as partes interessadas, incluindo o gerenciamento do local. As lacunas identificadas devem ser investigadas mais a fundo e um plano deve ser estabelecido para colmatar as lacunas. No entanto, o líder CCS pode agora começar a delinear o escopo do documento CCS. Um ponto a ser lembrado ao escrever o documento é que o documento CCS deve servir como um roteiro para reguladores, auditores e partes interessadas internas. Portanto, o CCS não deve ser uma duplicação de informações já contidas em outra área do sistema de qualidade. Em vez disso, um resumo de um elemento CCS com referências a outros documentos para grande parte dos detalhes é incentivado. O CCS deve incluir, mas não está limitado ao projeto da planta e do processo, equipamentos, pessoal, utilidades, controles de matérias-primas, fechamento de embalagens de produtos, gestão de atividades de fornecedores e terceirizados, validação de processos e esterilização, limpeza e desinfecção, sistemas de monitoramento, CAPA (ação corretiva e ações preventivas) e práticas de melhoria contínua. Cada um desses elementos do CCS deve descrever quais controles e práticas estão em vigor e o racional para cada controle estabelecido.
Soluções de brainstorming: investigue e feche as lacunas de conhecimento
Passo 7: Estabeleça CAPAs
Um programa CAPA 6 robusto é um requisito para todas as operações farmacêuticas, sem falar no Anexo 1. Para cada lacuna identificada, uma CAPA deve ser estabelecida para garantir que a lacuna identificada seja totalmente fechada para atender à intenção do requisito no anexo. A equipe deve considerar os riscos, não apenas os benefícios, associados às mudanças na estratégia operacional e/ou nos controles das instalações/engenharia. A equipe deve estar atenta às correções de curto prazo versus soluções de longo prazo e ser clara sobre a intenção de uma CAPA se for uma abordagem de curto prazo. Isso é particularmente importante em instalações mais antigas, onde uma melhoria de capital em larga escala pode ser necessária para atender às expectativas do anexo.
Etapa 8: Implementar CAPAs
Embora criar e documentar um plano de ação para as lacunas identificadas possa apaziguar um auditor no curto prazo, este é apenas o primeiro passo na correção. Para que uma mudança seja impactante, ela deve ser implementada. A conclusão oportuna das atividades de qualificação ou validação, a criação de novos SOPs e o treinamento dos operadores da planta são fundamentais para garantir o cumprimento do anexo. As empresas precisarão avaliar completamente a capacidade de seus recursos internos para implementar CAPAs e devem considerar o suporte terceirizado, se necessário.
Passo 9: Medir a Eficácia das CAPAs; Procure por consequências não intencionais
Após a implementação de uma nova mudança, particularmente aquela destinada a cumprir um novo requisito regulatório, a eficácia da mudança deve ser medida em relação ao resultado pretendido. Consequências não intencionais são frequentemente um efeito colateral de uma mudança notável. A equipe deve estar atenta a isso e buscar ativamente essas informações para impulsionar a melhoria contínua do CCS, bem como a eficiência operacional da organização.
Passo 10 : Mantenha o CCS vivo!
Colete, analise e use dados de monitoramento para manter e/ou modificar o CCS em uma abordagem de ciclo de vida.
Os dados só são úteis quando são analisados. O monitoramento dos dados coletados será uma das ferramentas mais importantes na avaliação da eficácia do CCS do site. A vigilância de pontos críticos de controle na estratégia de controle de contaminação deve ser uma tendência para informar a manutenção do próprio CCS. Um elemento central do CCS é a melhoria contínua baseada no monitoramento das saídas dos elementos da estratégia de controle. O CCS é um documento vivo que deve ser avaliado rotineiramente quanto ao seu design, controles e eficácia. Essa prática não apenas identificará áreas para melhorar a segurança e a qualidade do produto, mas os reguladores também esperarão que ocorra uma revisão periódica do CCS e que os dados de apoio que demonstrem sua adequação estejam disponíveis e acionados quando necessário.
Conclusão
As revisões do Anexo 1 revelam um foco reenergizado na gestão de risco e reflexo proativo do controle de contaminação. A jornada para a conformidade deve incluir um plano estratégico forte que invoque o sistema de qualidade como um facilitador e uma tomada de decisão baseada em risco para priorizar o conhecimento coletado. O objetivo é abrir a janela do Johari para garantir que o número de desconhecidos/desconhecidos seja minimizado enquanto os conhecidos/conhecidos aumentam ao longo do tempo.
Referências
- EudraLex Volume 4: Diretrizes da UE para Boas Práticas de Fabricação de Medicamentos para Uso Humano e Veterinário. Anexo 1 Fabricação de Medicamentos Estéreis, Comissão Europeia, Bruxelas, Bélgica, 2009: https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-4/2008_11_25_gmp-an1_en.pdf2.
- O modelo de janela Johari, https://www.communicationtheory.org/the-johari-window-model/
- Adaptado de Risk Intelligence: How to Live with Uncertainty, D. Evans, 2013
- ISO 31000 Risk Management - diretrizes, International Organization for Standardization, 2018
- Diretriz de Qualidade ICH Q9: Gestão de Risco de Qualidade; Conferência Internacional sobre Harmonização: 2006. www.ich.org
- Investigações de causa raiz para CAPA: claras e simples, James Vesper, DHI Publishing, 2020
Sobre os autores:
 Ryan Murray é consultor de qualidade e ciência de fabricação da ValSource, Inc. Seu foco é nas áreas de projeto e controle de instalações, transferência de tecnologia, qualificação de processos e gerenciamento de risco asséptico em produtos biológicos e de terapia avançada (ATMPs). Ele é um membro ativo da International Society for Pharmaceutical Engineering (ISPE) e da Parenteral Drug Association (PDA) e possui bacharelado em ciências biomédicas e mestrado em bioquímica e biofísica pela Texas A&M University. Ele pode ser contatado em rmurray@valsource.com.
Ryan Murray é consultor de qualidade e ciência de fabricação da ValSource, Inc. Seu foco é nas áreas de projeto e controle de instalações, transferência de tecnologia, qualificação de processos e gerenciamento de risco asséptico em produtos biológicos e de terapia avançada (ATMPs). Ele é um membro ativo da International Society for Pharmaceutical Engineering (ISPE) e da Parenteral Drug Association (PDA) e possui bacharelado em ciências biomédicas e mestrado em bioquímica e biofísica pela Texas A&M University. Ele pode ser contatado em rmurray@valsource.com.
 Amanda McFarland é consultora sênior de gerenciamento de risco de qualidade e microbiologia da ValSource, Inc. Ela é especializada na criação e implementação de programas de gerenciamento de risco e no desenvolvimento de estratégias baseadas em risco para uso em ambientes clínicos e comerciais. McFarland é membro ativo da Parenteral Drug Association (PDA), co-presidente do padrão PDA ANSI sobre QRM em processamento asséptico, membro do PDA Regulatory Affairs and Quality Advisory Board e instrutor dos cursos PDA sobre risco de qualidade implementação da gestão. Ela é bacharel em entomologia e mestre em micologia, ambas pela Universidade da Flórida. Ela pode ser contatada em amcfarland@valsource.com .
Amanda McFarland é consultora sênior de gerenciamento de risco de qualidade e microbiologia da ValSource, Inc. Ela é especializada na criação e implementação de programas de gerenciamento de risco e no desenvolvimento de estratégias baseadas em risco para uso em ambientes clínicos e comerciais. McFarland é membro ativo da Parenteral Drug Association (PDA), co-presidente do padrão PDA ANSI sobre QRM em processamento asséptico, membro do PDA Regulatory Affairs and Quality Advisory Board e instrutor dos cursos PDA sobre risco de qualidade implementação da gestão. Ela é bacharel em entomologia e mestre em micologia, ambas pela Universidade da Flórida. Ela pode ser contatada em amcfarland@valsource.com .
Nenhum comentário:
Postar um comentário