Pelo Dr. Bhushan Munjal, Ph.D.

O objetivo geral de uma empresa farmacêutica é produzir um medicamento que seja seguro, eficaz e estável. Idealmente, um produto liofilizado também deve ter uma aparência elegante, com uma morfologia de bolo fofo e ser liofilizado em pouco tempo. Estas propriedades são influenciadas pelo comportamento de fase dos componentes da formulação.
Recentemente, Dr. Bhushan Munjal, Ph.D., Universidade de Minnesota, EUA, apresentou um webinar descrevendo os efeitos complexos da combinação de excipientes em uma formulação e a importância de determinar as concentrações ideais e as condições de processamento para liofilização de formulações de proteínas. Esta nota técnica resume o webinar.
Efeitos interativos de componentes em formulações
de produtos Os atributos gerais do produto de uma formulação de proteína liofilizada são governados pelo comportamento de fase de componentes individuais da formulação durante as etapas de congelamento e secagem do processo de liofilização.
O processo de congelamento exerce múltiplos estresses que podem desestabilizar a proteína ativa. Estes incluem aumento da concentração de soluto e força iônica na matriz liofilizada, alteração do pH da solução liofilizada e formação de novas interfaces. A remoção do gelo por sublimação durante a fase de secagem também pode levar a efeitos indesejados por meio da dessorção da água descongelada e alterações do teor de água no produto.
Como resultado, as formulações de proteínas geralmente contêm vários excipientes para obter os atributos de produto desejados. Por exemplo, açúcares, surfactantes e tampões são adicionados para melhorar a estabilidade do produto, enquanto agentes de volume são adicionados para melhorar a manufaturabilidade, eficiência do processo e elegância do bolo (Figura 1).
A funcionalidade destes excipientes é muitas vezes dependente do seu estado físico na formulação durante o processamento e no produto final seco. Por exemplo, um lioprotetor deve permanecer amorfo enquanto um agente de volume (como manitol) é desejado no estado cristalino antes do início da secagem primária. A cristalização de um lioprotetor o separa da fase proteica, reduzindo assim seu efeito estabilizador. Por outro lado, a amorfização de um agente de volume cristalino (como o manitol) diminuiria sua temperatura crítica para liofilização. No entanto, o comportamento de fase dos excipientes é frequentemente afetado pela presença de outros componentes na formulação e isso pode afetar o desempenho do produto.
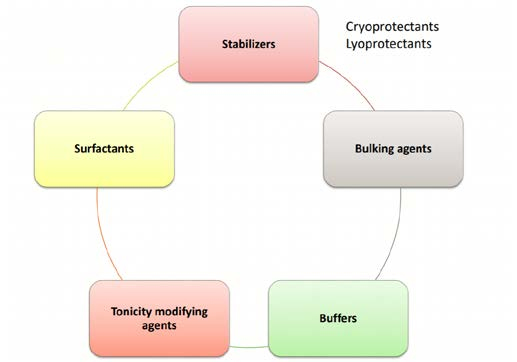
Figura 1: Excipientes em formulações de proteínas liofilizadas
No webinar, o Dr. Munjal descreveu vários estudos de caso retirados da literatura publicada para demonstrar como as interações entre os componentes da formulação podem afetar o processo de liofilização ou o desempenho do produto.
Estudos de caso
Açúcares que afetam a funcionalidade do agente de volume e vice-versa
Açúcares, por exemplo, sacarose e trealose são os lioprotetores mais populares, no entanto, a adição de açúcares geralmente tende a diminuir a temperatura de transição vítrea (Tg') das formulações de proteínas, exigindo assim uma liofilização relativamente mais longa ciclo.
Como resultado, um agente de volume, por exemplo, manitol ou glicina, é frequentemente adicionado a formulações à base de açúcar. Os agentes de volume têm altas temperaturas eutéticas (Teu), permitindo ciclos de liofilização mais rápidos, mantendo uma boa morfologia do bolo. No entanto, a eficácia desta combinação depende do estado físico dos dois excipientes durante o processamento e armazenamento, que por sua vez pode depender da proporção dos dois componentes, concentração ativa e condições de processamento. O primeiro conjunto de estudos de caso foi selecionado para destacar esse aspecto.
Estudo de caso 1: Sacarose com glicina
O primeiro estudo de caso de Bai et al. 2004 demonstrou a importância da relação sacarose:glicina no comportamento de fase dos dois componentes. Em altas proporções de sacarose para glicina (4:1 e 9:1), a funcionalidade do agente de volume pode ser completamente perdida, pois permaneceu substancialmente não cristalino, mesmo após a incorporação de uma etapa de hibridização durante a liofilização. Em contraste, em baixas proporções de sacarose para glicina (1:9, 1:4 e 2:3) a glicina era substancialmente cristalina mesmo sem hibridização (Figura 2).
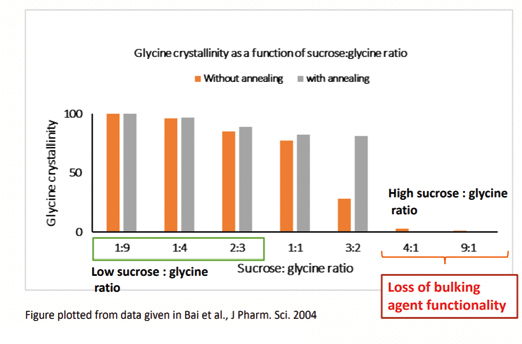
Figura 2: Estudo de caso 1 - Sacarose com Glicina
No entanto, nessas proporções, a baixa concentração de açúcar pode não fornecer o nível desejado de lioproteção. Em proporções intermediárias, a cristalinidade da glicina pode ser significativamente melhorada pela adição de uma etapa de recozimento à receita de liofilizado. Este estudo refletiu a importância da proporção dos dois excipientes e dos parâmetros de processamento na funcionalidade do excipiente.
Estudo de caso 2: Trealose com manitol
O segundo estudo de caso tratou da interação de manitol e trealose. Sundaramurthi et ai. 2010 mostraram que o manitol pode facilitar a cristalização do dihidrato de trealose nas soluções congeladas, enquanto a trealose tende a inibir a cristalização do manitol. Isso foi estudado com mais detalhes por Jena et al. 2016 e Jena et al. 2019, em que soluções contendo diferentes proporções de trealose:manitol foram liofilizadas com uma proteína modelo, por exemplo, albumina de soro bovino, BSA. Verificou-se que o estado físico dos dois excipientes depende da proporção trealose:manitol e proporção proteína:açúcar na solução pré-lio.
Estudo de caso 3: Sacarose com manitol
Os açúcares também podem alterar a forma sólida do manitol. O estudo de caso de Thakral et al. 2020 discutiu a formação do hemi-hidrato de manitol (MHH) quando usado com sacarose na proporção de 4:1. A MHH tende a liberar água por desidratação durante o armazenamento que pode interagir com outros componentes e comprometer a estabilidade do produto.
API/ Excipientes que afetam a funcionalidade de buffers
O segundo conjunto de estudos de caso discutiu o impacto de ativos e/ou excipientes na funcionalidade de buffer. Agentes tamponantes são adicionados aos produtos liofilizados para manter o pH na solução pré-liofilizada, durante a liofilização e na solução reconstituída. A seleção do tampão para esses produtos depende de vários fatores, incluindo (mas não limitado a), a constante de dissociação ácida (pKa) e a propensão de cristalização dos componentes do tampão durante o congelamento.
Estudo de caso 4: Inibição da cristalização do tampão A cristalização
de um componente tampão é indesejável, pois pode levar a 'mudanças de pH' e afetar a estabilidade do produto. Este estudo de caso de Thorat et al. 2020 discutiu sobre a agregação mediada por 'mudança de pH' de uma proteína modelo, BSA e sua mitigação.
Em alta concentração (100 mM), o componente básico do tampão fosfato de sódio (hidrogenofosfato dibásico) cristaliza levando a uma diminuição do pH. Isto resultou em agregação de proteína substancial após a ciclagem de congelamento-descongelamento. No entanto, a adição de celobiose (5% p/p) inibiu a cristalização do tampão e a mudança de pH associada, evitando assim a agregação de proteínas. A redução da concentração de tampão (10 mM) também impediu a agregação de proteínas. Aqui, a própria proteína estava em quantidade suficiente para inibir a cristalização do tampão.
Estudo de caso 5: Glicina com tampão fosfato de sódio
O estudo de caso final de Pikal-Cleland et al. 2002 discutiu sobre o impacto de um agente de volume, glicina na funcionalidade do tampão fosfato. A glicina tende a facilitar a cristalização do tampão e a mudança de pH associada. A glicina, de maneira dependente da concentração, mostrou um efeito pronunciado em baixa concentração de tampão (10 mM).
Conclusões
O desenvolvimento de um produto liofilizado estável com os atributos desejados requer uma seleção criteriosa das concentrações dos excipientes e otimização das condições de processamento, para evitar a perda da funcionalidade dos componentes individuais.
Para ver o webinar completo e baixar os slides, acesse os webinars arquivados em nosso site https://www.spscientific.com/Webinars/Archives/.
Referências
Bai, Shu Jun, et al. “Quantificação da cristalinidade da glicina por espectroscopia no infravermelho próximo (NIR).” Jornal de Ciências Farmacêuticas 93.10 (2004): 2439-2447.
Sundaramurthi, Prakash e Raj Suryanarayanan. "Influência de cosolutos cristalizantes e não cristalizantes na cristalização de trealose durante a liofilização." Pharmaceutical Research 27.11 (2010): 2384-2393.
Jena, Sampreeti, Raj Suryanarayanan e Alptekin Aksan. "Influência mútua de manitol e trealose no comportamento de cristalização em soluções congeladas." Pesquisa Farmacêutica 33.6 (2016): 1413-1425.
Jena, Sampreeti, et ai. "Estabilidade de formulações de albumina liofilizada: Papel da cristalinidade do excipiente e mobilidade molecular." International Journal of Pharmaceutics 569 (2019): 118568.
Thakral, Seema, Jayesh Sonje e Raj Suryanarayanan. "Comportamento anômalo de hemi-hidrato de manitol: Implicações na cristalização de sacarose em sistemas coliofilizados." International Journal of Pharmaceutics 587 (2020): 119629. Jena et al. 2016 (3)
Thorat, Alpana A., et ai. “Agregação de proteínas induzida por congelamento-Papel da mudança de pH e estratégias potenciais de mitigação.” Journal of Controlled Release 323 (2020): 591-599.
Pikal-Cleland, Katherine A., et ai. “Efeito da glicina nas mudanças de pH e estabilidade da proteína durante o congelamento-descongelamento em sistemas tampão de fosfato.” Jornal de Ciências Farmacêuticas 91,9 (2002): 1969-1979.