O que você precisa saber sobre a fabricação de produtos OTC
Por Julia Huang, Regulatory Affairs Associate, Bora Pharmaceuticals

Em termos mais gerais, um produto de venda livre (OTC) pode ser descrito como um medicamento disponível para automedicação que não requer receita médica. A automedicação é um tratamento comum para muitos problemas de saúde rotineiros, como dores de cabeça, alergias e doenças de pele. Os medicamentos OTC são projetados, rotulados e aprovados por várias agências regulatórias em todo o mundo para uso sem supervisão médica.
À medida que mais medicamentos passam para o status de OTC, as pessoas estão interessadas em desempenhar um papel mais ativo no gerenciamento de sua saúde e no controle de suas escolhas de saúde. Como resultado, os produtos OTC são geralmente aceitos como uma parte importante da saúde. No entanto, a automedicação traz riscos. A compreensão do que constitui um medicamento OTC e o modo de dispensação pode variar amplamente entre regiões e países.
Como faço para obter produtos OTC nos EUA?
Nos Estados Unidos, a venda de medicamentos sem prescrição ou OTC não se limita às farmácias. Apenas em casos raros os EUA OTC são armazenados atrás do balcão e dispensados por farmacêuticos registrados. Esses medicamentos OTC geralmente estão localizados nas prateleiras das farmácias de fácil acesso aos pacientes e também podem estar localizados em pontos de venda fora da farmácia, como mercearias, lojas de conveniência e grandes varejistas com descontos.
Os medicamentos OTC geralmente têm as seguintes características:
- seus benefícios superam seus riscos
- o potencial para uso indevido e abuso é baixo
- o consumidor pode usá-los para condições de autodiagnóstico
- tem rotulagem adequada aprovada por uma agência reguladora
- A supervisão médica não é necessária para o uso seguro e eficaz do produto
Mais de 300.000 medicamentos OTC são comercializados nos Estados Unidos, contendo cerca de 800 ingredientes ativos significativos. Isso inclui mais de 80 classes de medicamentos de venda livre ou categorias terapêuticas, variando de acne a medicamentos para controle de peso.
Com o aumento dos custos de saúde nos Estados Unidos, os consumidores gastam vários bilhões de dólares em medicamentos OTC para automedicação por ano. Portanto, é essencial para a Food and Drug Administration (FDA) dos EUA tomar medidas para garantir que os fabricantes desses produtos cumpram a Lei Federal de Alimentos, Medicamentos e Cosméticos (FD&C Act) e atendam a todos os requisitos regulamentares.
Como as empresas trazem medicamentos OTC para o mercado?
A revisão da FDA de medicamentos OTC é principalmente tratada pelo Centro de Avaliação e Pesquisa de Medicamentos (CDER) do Office of Non Prescription Drugs . O CDER supervisiona o desenvolvimento, revisão e regulamentação de produtos não prescritos. Os medicamentos OTC são desenvolvidos pelo processo de Monografia OTC ou pelo processo de Aplicação de Novo Medicamento (NDA) .
Originalmente, de acordo com a Lei de Alimentos, Medicamentos e Cosméticos (FD&C) , apenas os produtos que estiveram no mercado por um “período significativo de tempo” e “em uma extensão significativa” foram considerados para o status de OTC. Em 1972, o FDA iniciou um processo de Revisão de Medicamentos OTC para estabelecer monografias e avaliar a segurança e eficácia dos medicamentos OTC comercializados nos Estados Unidos na época.
Monografias de medicamentos OTC são uma espécie de "livro de receitas" que cobre ingredientes aceitáveis, dosagem, forma farmacêutica, formulação e rotulagem (indicações, avisos e instruções de uso) necessários e apropriados para o uso seguro e eficaz desse medicamento. O FDA revisou os ingredientes ativos e a rotulagem de mais de 80 categorias terapêuticas de medicamentos, em vez de revisar os medicamentos individuais (detalhado na Tabela 1).
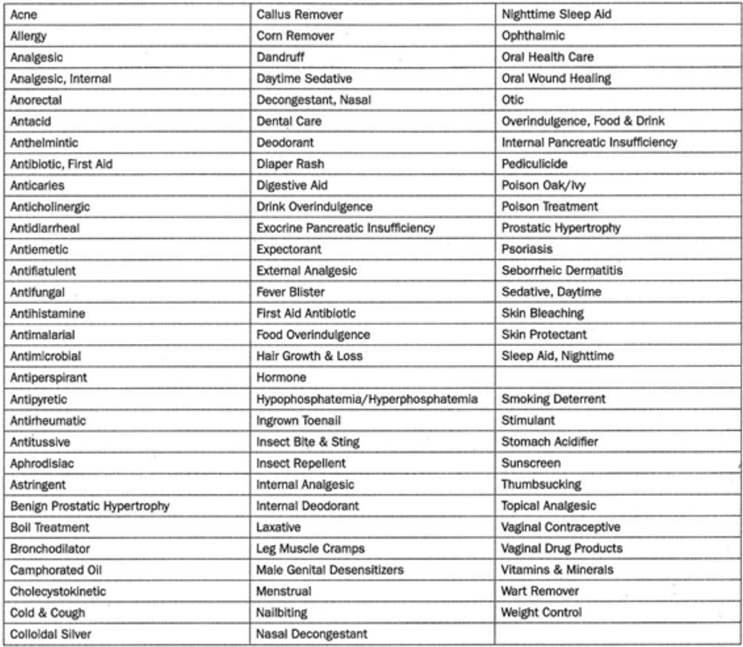
O FDA conseguiu tornar o processo mais eficiente agrupando os produtos em categorias e avaliando os ingredientes ativos em vez de cada produto individual. Após a revisão de cada categoria terapêutica, uma monografia OTC é desenvolvida e estabelecida como padrões por meio do processo de regulamentação pública de três fases:
- ligue para obter informações
- regras propostas
- regra final codificada
Cada fase requer uma publicação do Federal Register , incluindo na forma de Notificação Avançada de Proposta de Regulamentação (ANPR), Monografia Final Provisória (TFM) e Monografia Final (FM), respectivamente.
De acordo com os termos da revisão, o (s) ingrediente (s) farmacêutico (s) ativo (s) (API) em produtos OTC são categorizados em uma das três categorias:
- Categoria I: geralmente reconhecida como segura e eficaz (GRASE) para a indicação terapêutica reivindicada
- Categoria II: geralmente não é reconhecida como segura e eficaz (NGRASE) ou indicações inaceitáveis
- Categoria III: dados disponíveis insuficientes para permitir a classificação final
A Monografia Final estabelece as condições sob as quais certos medicamentos OTC são GRASE (Categoria I) e serão posteriormente codificados no Código de Regulamentações Federais (CFR) como regra final. Os medicamentos em conformidade com as monografias apropriadas podem ser fabricados e comercializados legalmente sem a pré-aprovação do FDA. Mais importante ainda, toda a atividade de fabricação de medicamentos OTC deve cumprir as Boas Práticas de Fabricação Atuais (CGMP) para a fabricação de produtos farmacêuticos. Os locais de fabricação de drogas e produtos farmacêuticos devem ser registrados no FDA. Além do registro, todas as empresas OTC devem listar formalmente todos os seus medicamentos em distribuição comercial nos Estados Unidos com o FDA. O FDA tem autoridade para conduzir inspeções para verificar a conformidade desses locais de fabricação. Os medicamentos OTC também devem ser “listados;
O processo de monografia pode ser muito demorado, pois os prazos da FDA para mover uma Monografia Final Provisória (TFM) para uma Monografia Final (FM) não foram definidos. Portanto, várias categorias de medicamentos ainda não foram submetidas a FM. Uma vez que uma categoria de produtos atinge o status de FM, os produtos classificados como Categoria II são considerados Não Monográficos e devem obter aprovação no processo de Aplicação de Novo Medicamento ou ser retirados do mercado em um prazo definido.
Quando uma monografia não foi finalizada, os produtos da Categoria III podem permanecer no mercado, mas precisam fornecer dados de segurança e / ou eficácia ausentes para serem avaliados pela FDA, que então pode permitir que o ingrediente seja movido para a Categoria I.
Após a publicação, uma Monografia Final pode ser alterada, por iniciativa da agência ou a pedido de qualquer "pessoa interessada". Monografias de medicamentos OTC são atualizadas para adicionar, alterar ou remover ingredientes, rotulagem ou outras informações pertinentes, conforme necessário.
O que o rótulo “Fatos sobre medicamentos” OTC significa para os consumidores?
O fato de um medicamento ser OTC (sem receita) em vez de prescrito não significa que seja isento de riscos. É especialmente importante que os pacientes entendam que todos os medicamentos, incluindo os OTCs, podem ter efeitos colaterais indesejados. Além dos benefícios que os medicamentos OTC oferecem, eles podem acarretar riscos, incluindo a possibilidade de efeitos colaterais indesejados, interações com medicamentos ou alimentos, ou danos devido a doses excessivas. Esses riscos são divulgados no rótulo “Fatos sobre medicamentos” em todos os produtos OTC.
Tal como acontece com os medicamentos prescritos, o CDER supervisiona os medicamentos OTC para garantir que sejam devidamente rotulados e que seus benefícios superem os riscos. Anteriormente, as informações sobre as instruções do produto, avisos e usos aprovados apareciam em locais diferentes no rótulo, dependendo do produto OTC e da marca. Encontrar informações sobre ingredientes inativos também tem sido um desafio para quem pode ser alérgico a qualquer ingrediente de um medicamento. Uma regra final sobre o uso de “Drug Facts” entrou em vigor em 1999, que padronizou o formato, conteúdo, cabeçalhos, gráficos e tamanho mínimo de tipo exigido para todos os medicamentos OTC.

Conforme a Fig. 1, as informações específicas no rótulo do Medicamento OTC devem incluir:
- Ingredientes ativos)
- Propósito
- Usos
- Avisos
- instruções
- Outra informação
- Ingredientes inativos
- Perguntas
Todos os medicamentos OTC devem ter o rótulo "Drug Facts" usando uma linguagem simples e um formato de fácil leitura para ajudar as pessoas a comparar e selecionar medicamentos OTC no momento da compra e ajudar o consumidor a compreender e seguir as informações de uso e segurança do produto sem supervisão médica.
Quais são os requisitos de fabricação para produtos OTC?
A fabricação de produtos OTC é idêntica à fabricação de produtos de prescrição (Rx), exceto para a aprovação do FDA para marketing e vendas desses produtos.
A FDA exige que todos os estabelecimentos OTC sigam as Boas Práticas de Fabricação (CGMP) e sigam os requisitos de rotulagem conforme especificado em 21 CFR Parte 201. Além das informações que devem aparecer no rótulo ou no recipiente imediato, a Regra de Fatos sobre Drogas (publicada pela FDA em 1999) padronizou os requisitos de conteúdo e formato para a rotulagem de todos os produtos OTC. A rotulagem da Drug Facts Rule requer, entre outras coisas, uma descrição dos ingredientes ativos e sua finalidade, os usos dos produtos, advertências, instruções, outras informações e ingredientes inativos.
Os requisitos da FDA para todos os produtos OTC incluem registro de estabelecimento de medicamentos, lista de produtos farmacêuticos e adesão aos regulamentos de BPF. Os requisitos da FDA para medicamentos OTC variam para produtos de monografia OTC e novos medicamentos OTC. Os medicamentos com ingredientes ativos publicados na monografia final de OTC podem ser comercializados sem a aprovação prévia do FDA. No entanto, se você planeja comercializar medicamentos OTC com ingredientes ativos que não fazem parte da monografia OTC, você deve obter a aprovação do FDA por meio do processo de aprovação do novo medicamento. Uma lista de ingredientes da monografia OTC junto com a regulamentação da FDA para medicamentos OTC pode ser encontrada no 21 CFR Parte 330.
Quais são os requisitos de embalagem da FDA para produtos OTC?
A FDA estabeleceu um requisito nacional uniforme para embalagens invioláveis de medicamentos OTC que melhorou a segurança das embalagens de medicamentos OTC e ajudou a garantir a segurança e eficácia dos medicamentos OTC. Uma embalagem à prova de violação tem um ou mais indicadores ou barreiras à entrada que, se violados ou ausentes, podem fornecer evidências visíveis aos consumidores de que ocorreu violação. As declarações devem ser incluídas nas caixas externas e internas, descrevendo claramente as características de inviolabilidade.
Além disso, os medicamentos OTC devem cumprir os requisitos de embalagem resistente a crianças em resposta a incidentes de crianças abrindo embalagens domésticas e ingerindo o conteúdo. Uma disposição está em vigor para um tamanho de recipiente a ser comercializado em embalagens não resistentes a crianças para idosos ou pessoas com deficiência que não possam usar a embalagem resistente a crianças, desde que seja adequadamente rotulada e embalagens resistentes a crianças também sejam fornecidas.
A demanda por medicamentos OTC está aumentando à medida que os governos buscam reduzir os custos de saúde, e as expectativas e interesses dos pacientes com a saúde estão se tornando mais ativos no gerenciamento de sua saúde. É responsabilidade da indústria farmacêutica e das autoridades regulatórias aumentar a conscientização pública sobre os benefícios e riscos envolvidos no uso de medicamentos OTC para automedicação, para que os pacientes possam usar esses medicamentos corretamente e minimizar as possibilidades de uso indevido e abuso de drogas.
Os fabricantes de medicamentos OTC devem cumprir os mesmos padrões de qualidade e requisitos regulatórios dos produtos com receita. No entanto, ao contrário dos produtos com receita, os produtos OTC devem ser comprovados como seguros e eficazes para uso sem supervisão de um profissional de saúde. Vários caminhos regulatórios estão disponíveis para comercializar medicamentos OTC nos EUA. Garantir a conformidade com as regras e regulamentos aplicáveis é essencial na arena dinâmica e desafiadora dos medicamentos OTC.

Nenhum comentário:
Postar um comentário