Nanoparticle Engineering: Revolutionizing Oral Drug Delivery - White Paper
Por Satu Lakio, Ph.D., Gerente de Desenvolvimento Farmacêutico, e Professor Niklas Sandler, Diretor de Tecnologia, Nanoforma
É um fato estabelecido que a taxa de falha dos medicamentos que entram nos testes de Fase I é superior a 90%. 1 Este é um número impressionante, considerando a enorme despesa e os muitos anos de trabalho árduo em toda a linha de descoberta e desenvolvimento de medicamentos que está por trás de cada medicamento experimental. Como os sistemas de saúde em todo o mundo continuam a ser desafiados a criar terapias mais eficientes e eficazes, há um interesse crescente em métodos para melhorar essa baixa taxa de sucesso.
Um obstáculo significativo para o lançamento de novos medicamentos é a complexidade crescente das moléculas dos medicamentos, o que contribui para o aumento da hidrofobicidade e menor solubilidade em água. Isso fica claro pelo contraste entre a solubilidade dos medicamentos dentro do pipeline de desenvolvimento e aqueles que chegam ao mercado: 70–90% dos medicamentos do pipeline se enquadram nas categorias de baixa solubilidade do Sistema de Classificação Biofarmacêutica (BCS). Enquanto isso, menos de 40% dos medicamentos no mercado se enquadram na mesma classificação. 2Com isso em mente, é evidente que as tecnologias que podem aumentar a solubilidade e a biodisponibilidade do medicamento têm grande potencial para melhorar a eficiência no desenvolvimento de medicamentos. A engenharia de nanopartículas - o processo de reduzir o tamanho das partículas do medicamento - surgiu como uma solução promissora para esse problema.
Melhorar a solubilidade e a biodisponibilidade
A baixa solubilidade e biodisponibilidade são as principais causas de atrito no pipeline de desenvolvimento de drogas. A solubilidade, definida como a capacidade de um soluto se dissolver em um solvente e dar um sistema homogêneo, é um parâmetro importante para os desenvolvedores de drogas. 3 É um dos fatores que influenciam se um medicamento pode atingir a concentração desejada na circulação sistêmica para um efeito terapêutico ideal. Essa característica costuma estar associada à biodisponibilidade, que se refere à extensão e à taxa com que um medicamento entra na circulação sistêmica de forma inalterada, atingindo assim sua área-alvo. 4
Uma proporção significativa dos medicamentos administrados por via oral é absorvida pelo corpo através do trato gastrointestinal. A baixa solubilidade em água resultará na diminuição da absorção do fármaco através da parede intestinal, conseqüentemente reduzindo a biodisponibilidade. A tendência de moléculas de drogas maiores e mais complexas que não se enquadram naturalmente na 'Regra dos Cinco' de Lipinski agrava esse problema, já que moléculas dessa natureza costumam exibir baixa biodisponibilidade aquosa. Consequentemente, com 70-90% das novas entidades químicas exibindo baixa solubilidade ou permeabilidade, a corrida começou para criar inovações tecnológicas que possam resolver o problema e criar um caminho para novos tratamentos chegarem aos pacientes. 2
Engenharia de nanopartículas como solução
Várias técnicas de engenharia de nanopartículas têm recebido atenção por sua capacidade de melhorar a solubilidade e a biodisponibilidade de compostos de drogas, abordando assim uma das principais causas de falha no desenvolvimento de drogas. APIs de engenharia em nanoescala têm um impacto dramático na área de superfície específica - um fenômeno diretamente correlacionado com o comportamento de dissolução. A relação entre área superficial e solubilidade foi desenvolvida a partir do modelo teórico de Ostwald-Freundlich, que é específico para partículas em nanoescala. 5
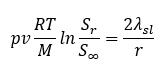
onde p = densidade do sólido, v = número de moles de íons formados a partir de um mol de eletrólito, R = constante de gás, T = temperatura, M = massa molar, S_r = a solubilidade de partículas de raio r, S_∞ = o solubilidade do sólido de uma superfície plana, λsl = tensão interfacial.
Uma área de superfície maior permite uma maior interação entre o soluto e o solvente, o que leva a uma melhor solubilidade. Na verdade, a redução do tamanho da partícula abaixo de 100 nm aumenta a área de superfície em 30 a 40 vezes em comparação com uma partícula de 10 µm. Extrapolando isso ainda mais, uma redução do tamanho de partícula de cerca de 50-100 nm pode aumentar a área de superfície em até 1000 vezes.
Diferentes abordagens de engenharia de nanopartículas que exploram essa relação podem, em termos gerais, ser divididas em abordagens baseadas no atrito mecânico "de cima para baixo" e processos de formação de solução para partícula "de baixo para cima". Nanomilling é um exemplo popular do primeiro e pode produzir com sucesso nanopartículas tão pequenas quanto 150 nm. Ao aumentar a energia livre de superfície, no entanto, a nanomilhamento pode introduzir domínios amorfos em partículas cristalinas, tornando-a inadequada para alguns APIs sensíveis. Além disso, a necessidade de surfactantes para estabilizar o material fresado em suspensão pode criar desafios no que diz respeito à estabilidade e vida útil ao longo da linha.
A secagem por spray é um exemplo de processo de solução para partícula de baixo para cima que já foi amplamente adotado na indústria farmacêutica. Esta técnica é particularmente útil para criar partículas API para entrega respiratória na faixa de baixo mícron e pode ser usada para aumentar a biodisponibilidade pela produção de partículas API em dispersões sólidas amorfas secas por pulverização. Essas dispersões são produzidas por atomização do API com um polímero, que atua para impedir a interação das partículas API. Uma desvantagem disso é que o polímero pode adicionar muito peso ao material pré-formulado resultante, o que pode tornar impossível criar algumas formulações na dose pretendida (ou seja, carga de droga) e no formato desejado. Embora essas técnicas tenham seus méritos e sejam úteis em certas situações, é claro que existe a necessidade de uma tecnologia que possa reduzir o tamanho das partículas para a faixa nanoescala baixa, de forma controlada e uniforme, sem a necessidade do uso de surfactantes ou outros excipientes. A tecnologia de Expansão Controlada de Soluções Supercríticas (CESS®) de propriedade da Nanoform fornece exatamente isso.
Avanços recentes na tecnologia de engenharia de nanopartículas
Avanços recentes levaram ao desenvolvimento da tecnologia patenteada CESS® nanoforming ™ da Nanoform, que reduz o tamanho das partículas API enquanto mantém um controle rígido da termodinâmica do sistema e, conseqüentemente, das propriedades da superfície. A técnica envolve a dissolução e extração de partículas API do dióxido de carbono supercrítico (scCO 2) Como o processo não requer excipientes, a necessidade de estudos de compatibilidade estendidos é significativamente reduzida, acelerando o início dos ensaios clínicos. Esta técnica patenteada é a única tecnologia existente que reduz com sucesso e uniformemente o tamanho das partículas do medicamento até 50 nm e, ocasionalmente, tão pequeno quanto 10 nm. Este é um grande avanço, pois aumentar a área de superfície a esta medida significa que muitos novos medicamentos considerados inviáveis podem ser revisitados. Ao melhorar significativamente as taxas de dissolução, solubilidade intrínseca e biodisponibilidade, a tecnologia da Nanoform tem o potencial de dobrar o número de compostos que chegam aos ensaios clínicos.
Melhorar a biodisponibilidade e a solubilidade dos compostos da droga também confere outra vantagem: diminuir a dose necessária para o efeito terapêutico. Ao reduzir a quantidade de API que precisa ser administrada, esse recurso ajuda a reduzir os custos de fabricação e a limitar o desperdício, além de reduzir os efeitos colaterais para os pacientes em alguns casos. Além disso, como o processo CESS ® nanoforming ™ não requer o uso de solventes orgânicos e possui uma pequena pegada de fabricação, há também um benefício ambiental substancial associado ao seu uso. À medida que a indústria trabalha para incorporar práticas mais sustentáveis, espera-se que esse recurso se torne cada vez mais importante.
Nanoformação em ação
As capacidades extraordinárias do processo CESS® nanoforming ™ foram demonstradas em um estudo sobre o piroxicam, um medicamento antiinflamatório não esteroidal. A diferença no comportamento farmacocinético (PK) em ratos entre partículas de piroxicam d50: 230 nm produzidas usando a tecnologia CESS® da Nanoform e partículas de piroxicam d50: ~ 2 µm foi avaliada.

Figura 1: Imagens de microscópio eletrônico de varredura (SEM) mostram que o piroxicam TM nanoformado permanece como partículas primárias individuais em suspensão e não se aglomera.
Uma formulação de suspensão simples foi desenvolvida para acomodar o estudo de PK. As partículas nanoformadas ™ d50: piroxicam de 230 nm e d50: ~ 2 µm produziram suspensões que foram facilmente redispersíveis. Imagens de microscópio eletrônico de varredura (MEV) do material mostraram que as nanopartículas de piroxicam produzidas usando o processo CESS ® nanoforming ™ da Nanoform permaneceram como partículas primárias individuais em suspensão e não se aglomeraram (Figura 1). Além disso, foi observado que o nanoformado ™ piroxicam apresentou melhor dissolução in vitro em comparação com as partículas de tamanho mícron (Figura 2).
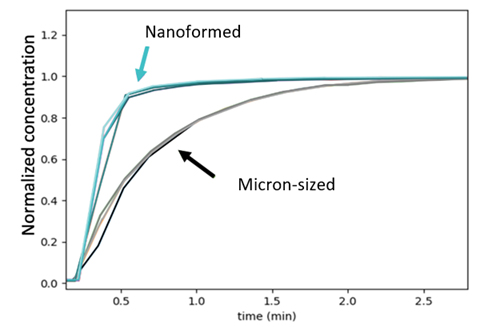
Figura 2: O piroxicam nanoformado mostra uma melhor dissolução in vitro em comparação com seus equivalentes de tamanho mícron.
No estudo de PK, a suspensão nanoformada ™ aumentou significativamente as concentrações plasmáticas de piroxicam em relação à forma de suspensão de tamanho mícron (Figura 3). O aumento foi mais pronunciado nos primeiros 80 minutos, pois a liberação do material TM nanoformado foi mais rápida. Até 480 minutos, a área sob a curva (AUC) foi 85-87% maior e o T máx foi alcançado duas a seis vezes mais rápido no grupo de suspensão nanoformada ™ em comparação com o grupo de referência de suspensão de tamanho mícron. Além disso, o C maxfoi 55-89% maior no grupo de suspensão nanoformada ™ dentro do tempo de acompanhamento de 480 minutos. Os resultados sugerem que é possível uma redução de mais de 50% na dose necessária para o efeito terapêutico, o que poderia ser ainda mais pronunciado com um tamanho de partícula menor. Esta excitante capacidade de redução da dose é altamente relevante para os compostos BSC II e possivelmente BSC IV - categorias nas quais se enquadram 70–90% de todos os medicamentos do processo de desenvolvimento de medicamentos. 2
Os resultados do estudo também demonstraram que uma dose oral de 20 mg / kg de nanoformado ™ piroxicam possuía propriedades farmacocinéticas superiores em comparação com micropartículas de piroxicam, com um valor de p inferior a 0,01 a 80 minutos, T max mais rápido , C max mais altoe AUC maior. Além das suspensões, o pó em cápsulas também foi estudado com uma dose de 5 mg / kg. Quando testado a 5 mg / kg, a suspensão e a mistura em pó do material nanoformado ™ na cápsula tiveram um desempenho semelhante e com bons resultados (Figura 3). Isso fornece fortes evidências da eficácia de ambas as formulações, portanto, pode-se obter confiança para o avanço dos testes em humanos. Ao todo, as propriedades superiores das formulações de piroxicam nanoformado ™ demonstradas no estudo destacam o imenso potencial da tecnologia e estabelecem as bases para testes em humanos.
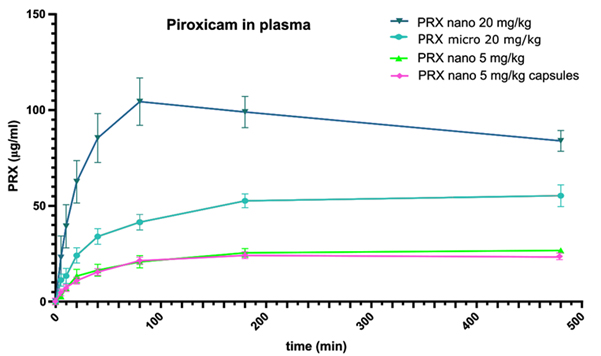
Figura 3: Níveis plasmáticos de piroxicam em ratos após administração de 20 mg / kg e 5 mg / kg de PRX. O piroxicam nanoformado mostra uma concentração melhorada em relação a outras formas de dosagem. A suspensão e o pó na cápsula apresentam perfis de liberação semelhantes.
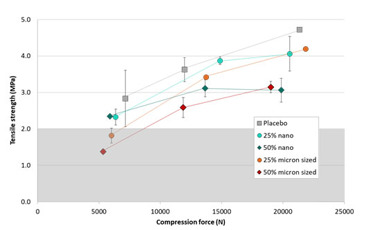
Com base no sucesso dos estudos iniciais sobre piroxicam, Nanoform desenvolveu uma formulação de comprimido de liberação imediata em preparação para ensaios clínicos em humanos (Figura 4). O comprimido é desenvolvido usando excipientes farmacêuticos típicos e é fabricado usando compressão direta. Para acomodar a dose de 20 mg no comprimido de 500 mg, a carga do medicamento foi de apenas 4%. Assim, como antecipado, o comportamento de compactação das misturas de pó foi muito bom. Normalmente, as cargas de drogas precisam ser maiores do que isso, portanto, cargas de drogas mais altas também foram investigadas para entender melhor o comportamento de compactação do material nanoformado ™. Os comprimidos foram compactados a partir de misturas de pó. A saber: placebo, 25% (m / m) nanoformado ™, 25% de tamanho mícron, 50% nanoformado ™ e 50% tamanho mícron. Como pode ser visto na Figura 5, a capacidade geral de comprimidos do nanoformado ™ e do piroxicam de tamanho mícron era muito semelhante. No entanto, o material nanoformado ™ precisava de menos força de compactação para formar comprimidos adequados com resistência à tração acima de 2 MPa, o que é considerado o padrão da indústria farmacêutica para resistência à tração muito boa. Os resultados também mostram que altas cargas de medicamento são possíveis ao usar material nanoformado ™, uma vez que o processo CESS® não requer excipientes. Nisso ele difere de outras técnicas - por exemplo, secagem por spray. Neste estudo, é demonstrada uma carga de medicamento de 50%, mas com alguns materiais o material nanoformado ™ puro também pode ser compactado em comprimidos, embora não processado ou micronizado não possa formar compactos. Isso indicou que a maior área de superfície do material nanoformado ™ é benéfica para a formação de ligações durante a compactação. o material nanoformed ™ precisava de menos força de compactação para formar comprimidos adequados com resistência à tração acima de 2 MPa, o que é considerado o padrão da indústria farmacêutica para resistência à tração muito boa. Os resultados também mostram que altas cargas de medicamento são possíveis ao usar material nanoformado ™, uma vez que o processo CESS® não requer excipientes. Nisso ele difere de outras técnicas - por exemplo, secagem por spray. Neste estudo, é demonstrada uma carga de medicamento de 50%, mas com alguns materiais o material nanoformado ™ puro também pode ser compactado em comprimidos, embora não processado ou micronizado não possa formar compactos. Isso indicou que a maior área de superfície do material nanoformado ™ é benéfica para a formação de ligações durante a compactação. o material nanoformed ™ precisava de menos força de compactação para formar comprimidos adequados com resistência à tração acima de 2 MPa, o que é considerado o padrão da indústria farmacêutica para resistência à tração muito boa. Os resultados também mostram que altas cargas de medicamento são possíveis ao usar material nanoformado ™, uma vez que o processo CESS® não requer excipientes. Nisso ele difere de outras técnicas - por exemplo, secagem por spray. Neste estudo, é demonstrada uma carga de medicamento de 50%, mas com alguns materiais o material nanoformado ™ puro também pode ser compactado em comprimidos, embora não processado ou micronizado não possa formar compactos. Isso indicou que a maior área de superfície do material nanoformado ™ é benéfica para a formação de ligações durante a compactação.

Figura 4: Nanoforma está desenvolvendo uma formulação de comprimido em preparação para testes em humanos.
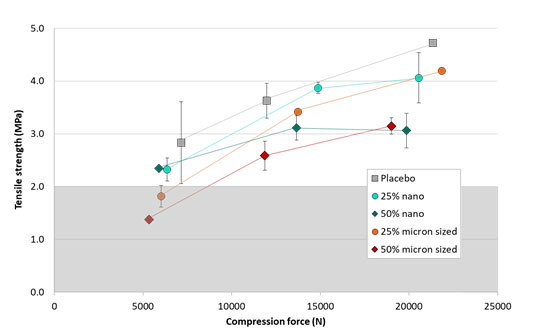
Figura 5: Capacidade de comprimidos de piroxicam nanoformado ™ em comparação com misturas de pó de tamanho mícron e placebo.
Perspectiva futura
Com 85% dos medicamentos mais vendidos nos Estados Unidos e na Europa por via oral, essa via de administração continua sendo uma das mais comuns no mundo. 3 Armado com os avanços recentes, Nanoform está agora bem posicionada para acessar esta via e começar a dosagem de piroxicam nanoformaed ™ em humanos em 2021.
É claro que, como solução para o problema recorrente de baixa biodisponibilidade e solubilidade de novos medicamentos no pipeline de descoberta e desenvolvimento, o poder da tecnologia de engenharia de nanopartículas promete abrir o caminho a seguir. Ao reduzir o tamanho das partículas do medicamento para aumentar sua área de superfície de maneira controlada e sem o uso de excipientes, a mais recente tecnologia CESS ® em particular tem mostrado seu enorme potencial para melhorar a eficiência na indústria farmacêutica. Este desenvolvimento emocionante tem implicações não apenas para novos candidatos a drogas, mas também para terapias desenvolvidas anteriormente que foram descartadas devido a problemas com solubilidade e biodisponibilidade.
REFERÊNCIAS:
- https://blogs.sciencemag.org/pipeline/archives/2019/05/09/the-latest-on-drug-failure-and-approval-rates
- Kalepu S, Nekkanti V. Estratégias de entrega de drogas insolúveis: revisão dos avanços recentes e perspectivas de negócios. Acta Pharm Sin B. setembro de 2015; 5 (5): 442-53. doi: 10.1016 / j.apsb.2015.07.003. Epub 24 de agosto de 2015. PMID: 26579474; PMCID: PMC4629443.
- Savjani KT, Gajjar AK, Savjani JK. Solubilidade de fármacos: importância e técnicas de realce. ISRN Pharm. 2012; 2012: 195727. doi: 10.5402 / 2012/195727. Epub 2012, 5 de julho. PMID: 22830056; PMCID: PMC3399483.
- Editor (es): Richard A. Polin, Steven H. Abman, David H. Rowitch, William E. Benitz, William W. Fox, Fetal and Neonatal Physiology (Fifth Edition), Elsevier, 2017, Página xxx, ISBN 9780323352147, https : //doi.org/10.1016/B978-0-323-35214-7.00180-3 . ( http://www.sciencedirect.com/science/article/pii/B9780323352147001803 )
- Sun J, Wang F, Sui Y, She Z, Zhai W, Wang C, Deng Y. Efeito do tamanho de partícula na solubilidade, taxa de dissolução e biodisponibilidade oral: avaliação usando coenzima Q₁₀ como nanocristais nus. Int J Nanomedicine. 2012; 7: 5733-44. doi: 10.2147 / IJN.S34365. Epub 12 de novembro de 2012. PMID: 23166438; PMCID: PMC3500035.
SOBRE OS AUTORES
Satu Lakio:
Satu Lakio, PhD, é gerente de desenvolvimento farmacêutico da Nanoform. Ela obteve seu PhD na Universidade de Helsinque, Finlândia, com foco no aprimoramento da compreensão do processamento de pó farmacêutico. A Dra. Lakio concluiu sua pesquisa de pós-doutorado na Monash University em Melbourne, Austrália, estudando pó para inalação. Ela já trabalhou em vários cargos dentro da academia e como Cientista Principal Associada na AstraZeneca e Gerente de Desenvolvimento Sênior na Orion Pharma. O Dr. Lakio é professor adjunto na Universidade de Helsinque e na Universidade da Finlândia Oriental (Tecnologia Farmacêutica). Atualmente, sua pesquisa se concentra no desenvolvimento farmacêutico de partículas nanoformadas ™.
Niklas Sandler:
Niklas Sandler, PhD, é Diretor de Tecnologia da Nanoform. Ele tem ampla experiência na academia e na indústria, com especialização em desenvolvimento de produtos farmacêuticos e ciência de materiais. Sua pesquisa em tecnologia farmacêutica foi publicada em mais de 100 artigos nas principais revistas internacionais. O trabalho anterior do professor Sandler se concentrou em novas tecnologias de manufatura farmacêutica, análise de processos, formulações para manufatura aditiva e caracterização de materiais.
SOBRE A EMPRESA
Nanoform Finland Plc é uma empresa inovadora de capacitação de medicamentos de nanopartículas. A Nanoform trabalha em conjunto com parceiros farmacêuticos e de biotecnologia globalmente para reduzir o atrito em testes clínicos e melhorar o desempenho de formulação de suas moléculas por meio de seus serviços de nanoformação. A tecnologia patenteada e escalonável de expansão controlada de soluções supercríticas (CESS ® ) produz partículas API nanoformadas de até 10 nm. Isso permite que moléculas fracamente solúveis no pipeline farmacêutico progridam para o desenvolvimento clínico, aumentando sua taxa de dissolução e melhorando sua biodisponibilidade. A tecnologia exclusiva da Nanoform oferece novas oportunidades em muitas aplicações de entrega de medicamentos com valor agregado .
Nenhum comentário:
Postar um comentário