Definindo a farmacovigilância e revisando sua história

Farmacovigilância (PV) é definida pela Organização Mundial da Saúde (OMS) como a ciência e as atividades relacionadas à detecção, avaliação, compreensão e prevenção de efeitos adversos ou qualquer outro problema relacionado a medicamentos. A PV concentra-se nas reações adversas a medicamentos, ou RAMs, que são definidas como qualquer resposta a um medicamento que seja nociva e não intencional, incluindo a falta de eficácia.
Em última análise, a PV está preocupada em identificar os perigos associados aos produtos farmacêuticos e em minimizar o risco de qualquer dano que possa ocorrer aos pacientes. Parece bastante simples, mas o processo pelo qual as empresas farmacêuticas passam para atender a esse requisito é bastante complexo. Mas antes, um breve histórico da Farmacovigilância. Incluí uma linha do tempo útil abaixo.
Linha do tempo histórica da farmacovigilância
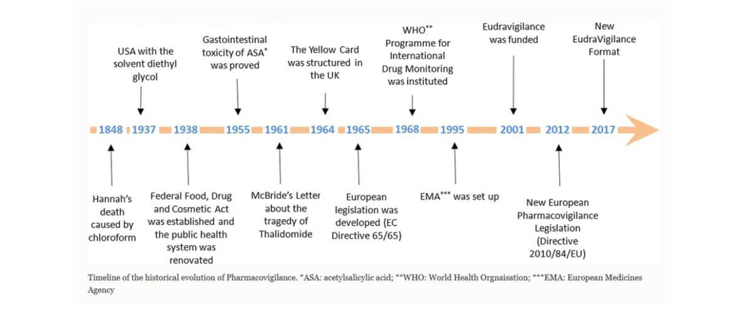
Embora existam muitos eventos históricos significativos que contribuíram para a gênese do PV, esses marcos mostrados acima são apenas alguns dos significativos. Um dos eventos relatados anteriormente foi quando uma jovem, Hannah, morreu após receber anestésico clorofórmio antes da remoção de uma unha infectada. Embora a causa da morte não tenha sido determinada na época, começou a aumentar a conscientização sobre os eventos adversos relacionados à anestesia. É interessante pensar em quantos séculos se passaram sem esse tipo de detecção ou fiscalização.
Uma Visão Geral da Legislação e Regulamentações Importantes na História Farmacêutica
Origens dos EUA e da FDA
A Lei Federal de Alimentos e Medicamentos dos EUA foi formada em 30 de junho de 1906 com a aprovação da Lei de Alimentos e Medicamentos Puros de 1906. Essa lei proibiu o comércio interestadual de alimentos e medicamentos adulterados e com marcas incorretas e forneceu os elementos básicos para a proteção do consumidor. Além disso, em 1911, a organização começou a regulamentar contra as falsas indicações de medicamentos terapêuticos.
Em 1937, houve mais de 100 mortes associadas a um solvente usado em um elixir de sulfanilamida. O clamor público levou à criação da Lei de Alimentos, Medicamentos e Cosméticos. Seu objetivo era renovar o sistema público de saúde e introduzir proteções quanto à segurança dos medicamentos antes de sua aprovação no mercado.
Origens da OMS e da EMA
A farmacovigilância européia mudou significativamente devido ao que é conhecido como a tragédia da talidomida, ou o desastre da talidomida, em 1961. O Dr. McBride, um médico australiano, observou uma conexão entre a malformação congênita de bebês e a talidomida. Em sua carta ao editor do Lancet Journal, ele destacou a incidência de malformações congênitas em bebês; 1,5% aumentou para 20% em mulheres que tomaram talidomida, que era comercializada como pílula para dormir, durante a gravidez [1]. A tragédia da talidomida levantou questões sobre a confiabilidade dos testes, operações da empresa e a importância do monitoramento das drogas após seu lançamento no mercado.
Em 1968, foi formado o Programa Internacional de Monitoramento de Medicamentos da OMS e, em 1995, foi criada a Agência Europeia de Medicamentos (EMA). Embora houvesse outras atualizações legislativas e regulatórias importantes, uma das principais atualizações foi a definição formal de um Evento Adverso como “uma resposta a um medicamento nocivo e não intencional”. Esta definição abrangente abrange qualquer evento adverso após o uso de um medicamento, incluindo erros de medicação e usos fora dos termos do uso autorizado.
Todos esses eventos e outros abriram o caminho para uma maior conscientização sobre a formalidade da Notificação de Eventos Adversos e as responsabilidades das empresas de marketing em relação à segurança dos medicamentos. A importância dessa evolução não pode ser enfatizada o suficiente. Os clientes com os quais nos associamos na missão de Life Sciences também são impactados diretamente por essa prática, que é executada por meio de um processo complexo.
Fontes:
- McBride WG. Talidomida e anomalias congênitas. Lanceta. 1961; ii:1358.
Nenhum comentário:
Postar um comentário