Um problema insolúvel? Superando desafios de solubilidade de medicamentos orais com polímeros funcionais
Por Dr. Thomas Endres, chefe de novos produtos e materiais, Evonik Corporation

Quase metade dos medicamentos atualmente comercializados e cerca de 90% daqueles em desenvolvimento clínico estão associados à baixa solubilidade ou permeabilidade do medicamento. Este artigo é a primeira parte de uma série de duas partes sobre aprimoramento de solubilidade. Aqui discutiremos os fundamentos do aprimoramento da solubilidade e a formulação e fabricação de produtos que aumentam a solubilidade. Também abordaremos dúvidas comuns sobre o tema.
Introdução ao aprimoramento de solubilidade
O sistema de classificação biofarmacêutica (BCS) classifica os medicamentos de acordo com sua permeabilidade e solubilidade. Drogas com baixa solubilidade e/ou permeabilidade são drogas do tipo classe II ou IV, e estas requerem tecnologias de formulação especiais para aumentar a solubilidade. Ao longo dos últimos anos, as drogas que se enquadram nas classes II ou IV têm aumentado constantemente. Em 2018, um estudo mostrou que aproximadamente um terço dos medicamentos aprovados se enquadravam nessas categorias. [1] Para novas entidades químicas, mais de 90 por cento são classificados como classe II ou IV. As tecnologias de aumento de solubilidade estão, portanto, ganhando importância crescente e são necessárias para liberar o potencial de novos candidatos a medicamentos e permitir sua entrada no mercado comercial.
Ao examinar as tecnologias usadas para melhorar a solubilidade desde a década de 1980, os lipídios são a primeira escolha dos formuladores. [2] No entanto, a aplicação de dispersões sólidas por transportadores poliméricos está crescendo rapidamente devido à sua versatilidade e eficácia com uma variedade de APIs difíceis de solubilizar.
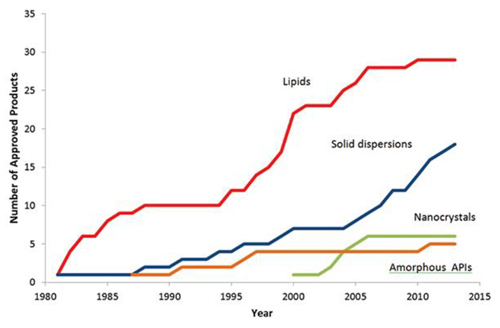
Figura 1 Melhoria da biodisponibilidade – Análise do uso histórico de tecnologias de solubilização, DDD 2014 Marshall Crew Agere Pharmaceuticals
Existem três fatores principais que precisam ser controlados ao projetar um medicamento para aumentar a solubilidade: o transportador polimérico; o processo de fabricação; e a correspondência com a API desejada. Ao controlar esses três fatores, a biodisponibilidade, o perfil de liberação do medicamento e a capacidade de fabricação do seu medicamento final podem ser otimizados.
Regra dos Cinco de Lipinski: Everolimus, Ivacaftor e Etravirina
Ao trabalhar no aprimoramento da solubilidade, a Regra dos Cinco de Lipinski é um guia importante. Esta regra diz que se houver mais de cinco doadores de ligação H em uma molécula de medicamento, ou mais de 10 aceitadores de ligação H, ou se o peso molecular for maior que 500 Da, ou o LogP for maior que cinco, então há uma chance maior de solubilidade e biodisponibilidade problemáticas. [3]
Everolimus é um bom exemplo. Ao examinar os parâmetros, podemos ver que a droga possui 13 aceptores de ligação H e um peso molecular de quase 1 kDa. Este é um API pouco solúvel que requer técnicas especiais para aumentar a solubilidade. [4]
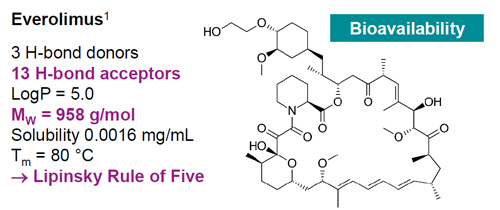
Figura 2 Everolimus
Mas a solubilidade e a biodisponibilidade da droga não são tudo. Existem outros parâmetros que precisam ser considerados e controlados, como a capacidade de fabricação. O ivacaftor, por exemplo, também é um medicamento pouco solúvel e com alto ponto de fusão. Isso significa que é importante escolher um processo de fabricação à base de solvente, como secagem por pulverização, em vez de um processo à base de fusão.
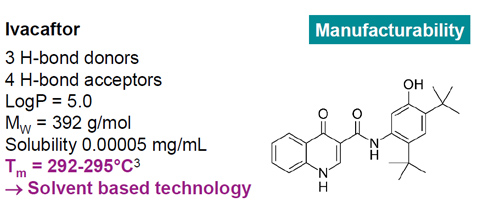
Figura 3 Ivacaftor
Um terceiro exemplo é a Etravirina. Este também é um fármaco pouco solúvel com um ponto de fusão relativamente alto. Ao mesmo tempo, também possui uma baixa temperatura de transição vítrea (T g ). Isso significa que há uma alta tendência do fármaco recristalizar na matriz polimérica, o que limita a estabilidade do produto. A carga de fármaco não deve ser muito alta para evitar a recristalização e levar a uma estabilidade de armazenamento limitada.
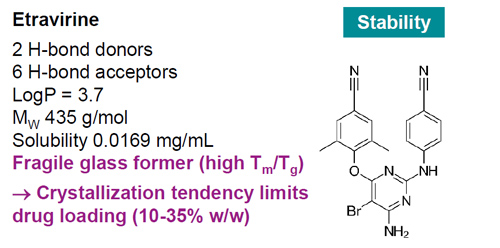
Figura 4 Etravirina
Maximizando os benefícios das dispersões sólidas amorfas (ASDs)
Em uma dispersão sólida amorfa (ASD), uma molécula de API é dispersa em uma matriz polimérica. O sistema contém energia potencial armazenada – que pode ser comparada à de uma mola comprimida. Quando o ASD é imerso no meio, a energia é liberada e a droga e o carreador polimérico são dissolvidos rapidamente em uma solução supersaturada. Este modelo é comumente referido como uma “mola e pára-quedas”.
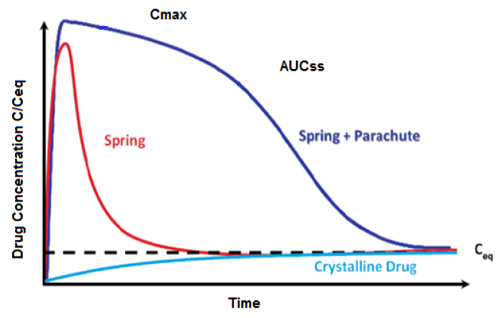
Figura 5 O modelo de mola e pára-quedas [5]
Neste ponto, a droga deve ser estabilizada e mantida em solução por tempo suficiente para permitir que seja absorvida pelo organismo. O polímero em solução pode estabilizar o fármaco para evitar sua recristalização. Os polímeros que podem estabilizar são adequados para aumentar a solubilidade. Estes incluem polimetacrilatos, derivados de celulose como HPMC e HPMCAS, copolímeros vinílicos como PVA e PVP/VA64 e copolímeros de enxerto de polivinil caprolactama-polivinil acetato-polietilenoglicol. O foco deste artigo são os polímeros de polimetacrilato.
Os transportadores poliméricos
Existem algumas regras e parâmetros gerais que devem ser considerados ao escolher o veículo certo para uma formulação. O parâmetro mais importante é a solubilidade do API no carreador polimérico que determinará a capacidade de carga. Outro parâmetro importante é o peso molecular do polímero.
Em geral, um polímero de maior peso molecular (M w ) é benéfico para o aumento da solubilidade. Isso permitirá uma melhor estabilização do fármaco e das moléculas do fármaco na matriz. Em soluções supersaturadas, um polímero de peso molecular mais alto evita a recristalização, e o peso molecular também afeta a temperatura de transição vítrea (T g ) e a viscosidade do fundido. Os dois últimos parâmetros normalmente aumentam com o aumento do peso molecular.
Uma T g mais alta é benéfica para a estabilidade de armazenamento para evitar a recristalização no produto final do medicamento. A capacidade de calor também é um parâmetro importante porque é muito importante para o processamento térmico do polímero por técnicas de extrusão hot-melt. Existem outros parâmetros de processamento que devem ser considerados para a fabricação de um medicamento. Estes incluem higroscopicidade e propriedades mecânicas, como compressibilidade. Essas são propriedades que precisam ser consideradas na escolha do melhor carreador polimérico para uma formulação.
O uso de polímeros de poli(met)acrilato EUDRAGIT® para melhorar a solubilidade
Os polímeros listados na Tabela 1 são particularmente adequados para aumentar a solubilidade. Todos esses polímeros são fabricados de maneira controlada por polimerização de radicais livres, o que permite janelas de especificação estreitas e baixa variabilidade de lote para lote. Os polímeros são monografados em farmacopéias relevantes em diferentes regiões.
Tabela 1 Polímeros de poli(met)acrilato EUDRAGIT ® mais adequados para aumento da solubilidade
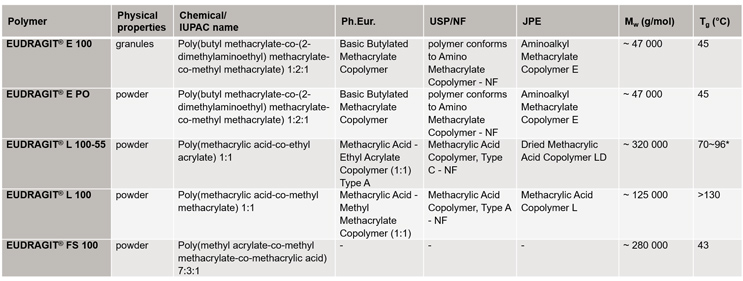
Os dois produtos nos quais gostaríamos de focar neste artigo são o EUDRAGIT® E e o EUDRAGIT® L porque são particularmente adequados para aumentar a solubilidade.
EUDRAGIT® E – um polímero catiônico
Este produto é um copolímero de metacrilato de dimetilaminoetil, metacrilato de butila e metacrilato de metila. O polímero é solúvel em sucos gástricos até pH 5 e incha além de pH 5. Historicamente, o polímero tem sido usado principalmente para aplicações de drogas de liberação imediata, como um revestimento protetor, para proteção contra umidade ou mascaramento de sabor. O polímero EUDRAGIT® E também é um formador de matriz e um veículo potente para aumentar a solubilidade, especialmente devido à sua capacidade de interagir com uma ampla variedade de tipos de API.
A funcionalidade amino do EUDRAGIT® E é protonada em condições fisiológicas. A carga catiônica pode interagir com funcionalidades aniônicas nas moléculas da droga, por exemplo, com grupos de ácido carboxílico. Ao mesmo tempo, a amina também atua como um doador de elétrons, o que permite a interação com grupos funcionais aceitadores de elétrons, como funcionalidades aromáticas, no API. Interações hidrofóbicas também são possíveis.
A amina e as funcionalidades hidrofílicas e hidrofóbicas do polímero permitem a formação de micelas, o que impede a recristalização do fármaco na solução supersaturada. Isso contribui para o mecanismo de pára-quedas que mantém o API dissolvido por tempo suficiente para ser absorvido pelo corpo.
Processamento térmico de EUDRAGIT® E
A Figura 6 mostra a capacidade térmica do EUDRAGIT® E em função da temperatura, que é uma característica térmica chave do polímero. A capacidade térmica aumenta com o aumento da temperatura, e um pico além da Tg indica um aumento da flexibilidade do polímero. O polímero pode ser processado além dessa temperatura. A temperatura de degradação é de 150°C, portanto, a janela de operação para o processamento térmico do EUDRAGIT® E está definida.
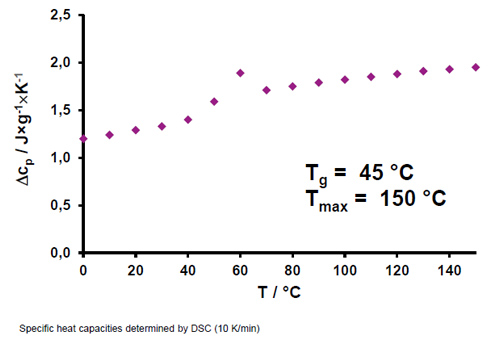
Figura 6 Capacidades específicas de calor de EUDRAGIT ® E (determinadas por DSC)
Viscosidade de EUDRAGIT® E
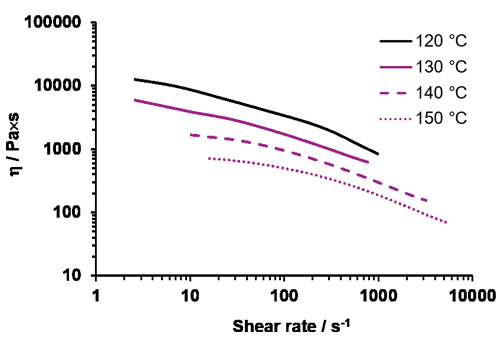
Figura 7 Viscosidade de EUDRAGIT® E em função da taxa de cisalhamento em diferentes temperaturas (determinada por reômetro capilar de alta pressão)
Na figura 7, a viscosidade do EUDRAGIT® E é mostrada em função da taxa de cisalhamento. A viscosidade diminui com o aumento da taxa de cisalhamento e da temperatura. Esses dados são úteis para encontrar as condições operacionais corretas em uma extrusora.
A interação de diferentes ingredientes nas formulações também deve ser considerada. O ibuprofeno, por exemplo, é um plastificante muito forte para o EUDRAGIT® E. A Figura 8 mostra que a Tg diminui com o aumento da concentração de ibuprofeno.
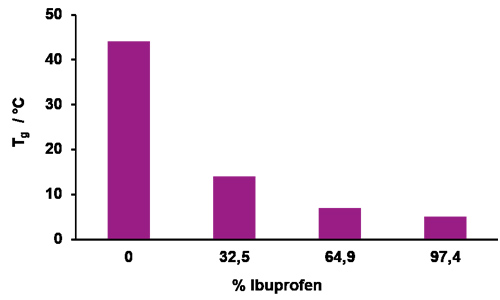
Figura 8 T g de misturas de EUDRAGIT® E 100-ibuprofeno (determinado por DSC)
EUDRAGIT ® L – polímeros aniônicos
Historicamente, os produtos EUDRAGIT® L têm sido usados para revestimentos entéricos e formulações de matriz de liberação prolongada. Existem dois tipos de EUDRAGIT® L: L 100 e L 100-55. O EUDRAGIT® L 100 começa a se dissolver além do pH 6 e o EUDRAGIT® L 100-55 começa a se dissolver além do pH 5,5.
Ambos os polímeros EUDRAGIT® L são transportadores eficazes para aumentar a solubilidade de uma ampla gama de APIs. Uma razão para isso é a interação dos grupos funcionais de ácido carboxílico com grupos funcionais de moléculas de drogas. Os polímeros EUDRAGIT® L exibem valores de T g relativamente altos . Valores altos de T g reduzem a mobilidade das moléculas de API na matriz polimérica e evitam a recristalização, aumentando assim a estabilidade de armazenamento do produto final do medicamento. Os polímeros EUDRAGIT® L são muito versáteis: podem ser usados em secagem por pulverização, extrusão hot-melt e granulação top-spray.
Processamento térmico de EUDRAGIT ® L
A Figura 9 mostra a capacidade térmica do EUDRAGIT® L 100 em função da temperatura. A T g para EUDRAGIT® L 100 está acima de 130 °C e a degradação começa na mesma faixa de temperatura. Isso leva a uma janela operacional limitada para processamento. Normalmente, um plastificante é necessário.
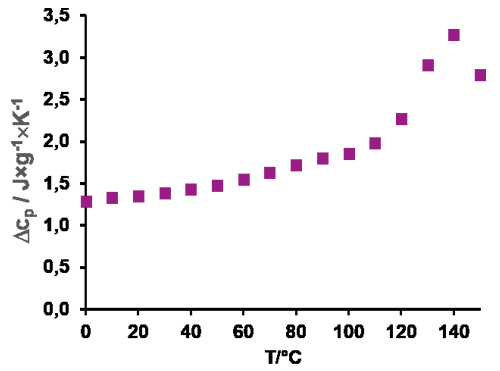
Figura 9 Capacidade de calor específico do EUDRAGIT® L 100 em função da temperatura (determinada por DSC)
A Figura 10 mostra a capacidade térmica do EUDRAGIT® L 100-55 em função da temperatura. A Tg de EUDRAGIT® L 100-55 é de 70-96 °C (dependendo da técnica de DSC utilizada). A temperatura máxima de processamento é de 140 °C.
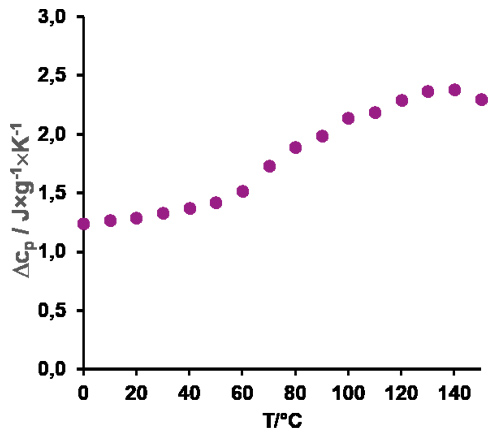
Figura 10 Capacidades de calor específico de EUDRAGIT® L 100-55 em função da temperatura (determinada por DSC)
Para ambos os tipos de EUDRAGIT® L, plastificantes farmaceuticamente aceitos, como citrato de trietila (TEC), podem ser usados. A Figura 11 mostra a Tg em função da concentração de plastificante.
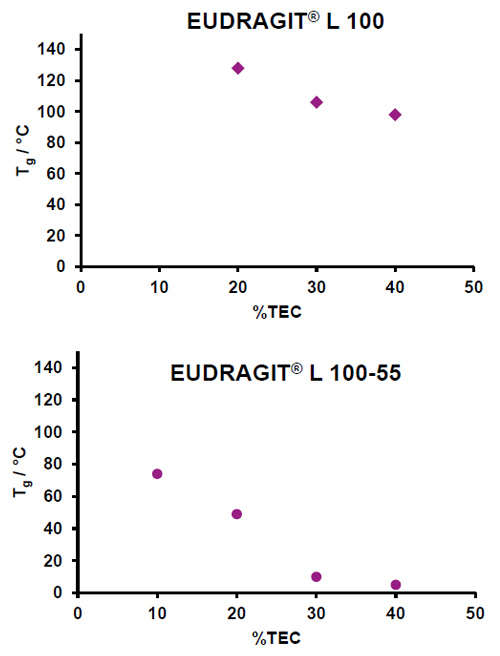
Figura 11 T g de EUDRAGIT L 100 e L 100-55 em função da concentração de plastificante (determinada por DSC)
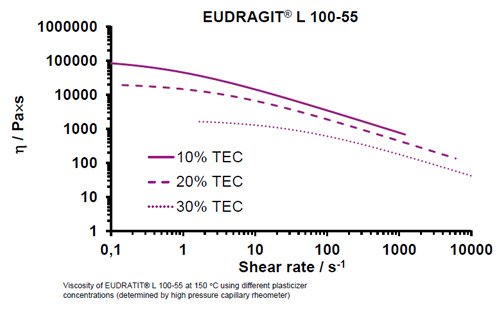
Figura 12 Viscosidade de EUDRAGIT® L 100-55 a 150 °C com diferentes concentrações de plastificante (determinado por reômetro capilar de alta pressão)
A Figura 12 mostra a progressão da viscosidade do EUDRAGIT® L 100-55 em função da taxa de cisalhamento. Os dados foram obtidos à temperatura constante de 150 °C usando três concentrações diferentes de plastificante. A viscosidade pode ser controlada ajustando a concentração e a temperatura do plastificante.
Conclusão
Os polímeros EUDRAGIT® apresentados neste artigo são veículos eficazes para aumentar a solubilidade. Esses polímeros termoplásticos são adequados para diferentes técnicas de fabricação, incluindo extrusão por fusão a quente. Os polímeros apresentam boa processabilidade durante a extrusão hot melt em torque moderado.
Os especialistas da Evonik terão todo o prazer em oferecer suporte com informações técnicas para encontrar os parâmetros de processamento corretos. Nas últimas duas décadas, a Evonik trabalhou com clientes para ajudar a escolher o excipiente de polímero, a tecnologia de processo e as soluções de formulação certas para superar a baixa solubilidade dos APIs. Saiba mais sobre as soluções de entrega de medicamentos da Evonik, incluindo a documentação específica do produto em nossa plataforma onCare ou visite nosso site www.evonik.com/eudragit . Para entrar em contato com a Evonik Health Care com perguntas sobre melhoria de solubilidade, envie um e-mail para Healthcare@evonik.com .
Sobre o autor
O Dr. Thomas Endres é um especialista em excipientes poliméricos para formas farmacêuticas orais e parenterais e possui ampla experiência na gestão de inovação e projetos de clientes. Thomas estudou química macromolecular na Universidade de Marburg, na Alemanha, antes de concluir sua pesquisa de doutorado no Instituto de Tecnologia Farmacêutica em Marburg. Thomas ingressou na Evonik em 2012 e ocupou diferentes cargos em P&D na Alemanha e como gerente de biomateriais nos EUA
Referências
- M. Hanada et al., Journal of Pharmaceutical Sciences , 2018 (107),1, 362
- Melhoria da biodisponibilidade – Análise do uso histórico de tecnologias de solubilização, DDD 2014 Marshall Crew AgerePharmaceuticals
- Lipinski, J. Farmacologia. Tóxico. Métodos, 2000; 44:235
- www.drugbank.ca; Everolimo
- Jermain SV et al., International Journal of Pharmaceutics, 2018, 535(1): 379-392
Nenhum comentário:
Postar um comentário