A importância do pensamento de ponta a ponta durante o desenvolvimento de medicamentos
Por Dr. Kashif Ghaffar, Farmacêutico para Validação de Processos, Pfizer CentreOne

Ao longo de um programa de desenvolvimento de medicamentos, é importante criar robustez e flexibilidade no processo de fabricação. Neste artigo, o Dr. Kashif Ghaffar, farmacêutico de validação de processo nas instalações da Pfizer em Freiburg, discute o que precisa ser considerado durante o desenvolvimento do produto em preparação para a fabricação comercial.
Visão de ponta a ponta
Durante o desenvolvimento inicial de medicamentos, há uma tendência de adotar uma estratégia 'adequada ao propósito' ao produzir formulações para ensaios clínicos. Essa abordagem é compreensível, considerando que apenas um em cada dez compostos que entram em ensaios clínicos se tornará produtos registrados. No entanto, é importante construir robustez para a fabricação no início do desenvolvimento e se preparar para o aumento de escala.
Pode haver razões para mudar a formulação ou a estratégia do processo durante o desenvolvimento inicial do produto (por exemplo, compressão direta para abordagem de granulação). Como resultado, ser ágil por ter acesso a uma ampla gama de equipamentos de processamento com capacidade de escalonamento é extremamente vantajoso.
O uso de estratégias de processamento contínuo, como compactação de rolos e mistura contínua, oferece grande potencial para flexibilidade de tamanho de lote. Para lotes maiores, basta executar o processo por mais tempo. As diretrizes 1,2 de 'aumento de escala e alterações pós-aprovação' (SUPAC) do FDA fornecem uma estrutura útil para aumento de escala de fabricação e é altamente benéfico se o equipamento da mesma classe SUPAC estiver disponível para desenvolvimento, aumento de escala e fabricação comercial .

Figura 1. Certifique-se de que o equipamento de processamento esteja disponível para aumento de escala para fabricação em maior escala
Expectativas regulatórias
Os princípios para 'Desenvolvimento Farmacêutico', com relação às expectativas regulatórias, são descritos no ICH Q8 3 e um elemento importante é o Quality-by-Design (QbD). O princípio básico por trás do QbD é que “a qualidade deve ser incorporada a um produto com uma compreensão do produto e do processo pelo qual é desenvolvido e fabricado, juntamente com o conhecimento dos riscos envolvidos na fabricação do produto e a melhor forma de mitigar esses riscos” .
A QbD foi adotada pelas agências reguladoras como uma 'melhor prática' para o desenvolvimento de produtos farmacêuticos, e a FDA e a EMA publicaram recentemente as conclusões de sua primeira avaliação paralela dos elementos QbD dos pedidos de autorização de comercialização 4 . Um aspecto importante do QbD é entender e controlar o processo de fabricação do produto e o impacto que cada etapa do processo tem umas nas outras e nos atributos críticos de qualidade. Definir os parâmetros críticos de qualidade do processo (por exemplo, fluxo/temperatura do ar, velocidade do rotor, taxa de pulverização) e, em seguida, monitorar esses parâmetros durante a fabricação é uma prática padrão na fabricação farmacêutica.
Este mapeamento da relação entre as entradas do processo e os atributos críticos de qualidade pode ser descrito como a definição do 'espaço de design' para um processo e é um importante elemento de contribuição para QbD. O conhecimento adquirido de produtos e processos será vantajoso ao longo de todo o ciclo de vida, como nas atividades de validação subsequentes devido a alterações de equipamentos ou matérias-primas. Uma excelente revisão de QbD relacionada ao desenvolvimento de produtos farmacêuticos é fornecida por Yu, et al. 5
Uma representação esquemática do conceito QbD é mostrada na Figura 2 e a relação de 'Design Space' e QbD é mostrada na Figura 3.
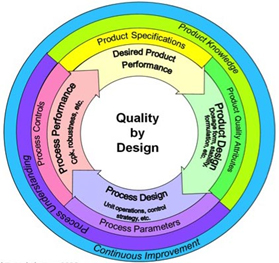
Figura 2 . Conceito de qualidade por design (QbD) conforme apresentado pela US Food and Drug Administration (FDA) 6
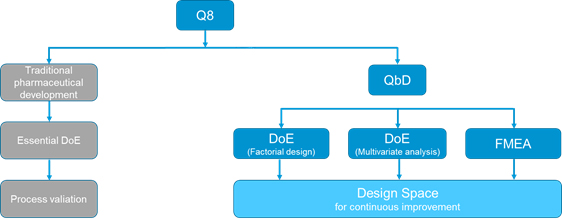
Figura 3. Prática atual de desenvolvimento farmacêutico (Q8) versus a abordagem tradicional
Existe uma estreita relação entre as diretrizes ICH Q8 (Desenvolvimento Farmacêutico), Q9 (Gestão de Riscos de Qualidade) 7 e Q10 (Sistema de Qualidade Farmacêutica) 8 . Essas diretrizes fornecem uma abordagem estruturada desde o desenvolvimento inicial do produto até o produto comercial e destacam a importância da gestão do conhecimento durante o ciclo de vida do produto. A relação entre essas diretrizes é mostrada na Figura 4.
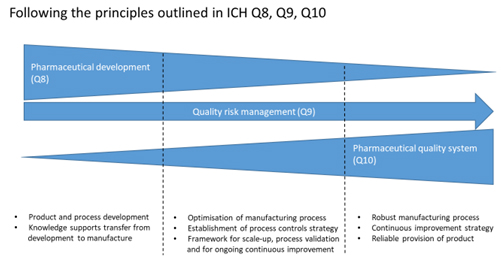
Figura 4. Esquema ilustrando a relação entre ICH Q8, Q9 e Q10 ao longo do processo de desenvolvimento de medicamentos
Antecipar e gerenciar problemas de fabricação
Ter conhecimento e experiência completos em processos de fabricação de doses vendidas orais ajuda a identificar possíveis problemas e facilita a aplicação de práticas apropriadas para evitar problemas. Por exemplo, a uniformidade do conteúdo da droga pode ser um problema durante a mistura de pó devido aos efeitos de segregação, e é importante que um CDMO tenha experiência em lidar com tais situações.
Outros problemas podem incluir a 'adesão' do comprimido aos perfuradores (que pode ser resolvido pelo uso de revestimentos antiaderentes nos perfuradores do comprimido) e a 'junção' durante o revestimento do comprimido (evitada pelo controle cuidadoso dos parâmetros do revestimento).
Conclusões
Uma visão de ponta a ponta do ciclo de vida do produto ao longo do desenvolvimento do produto é fundamental. Embora seja esperado um grau de pragmatismo durante o estágio inicial de desenvolvimento, é fundamental estar ciente dos aspectos práticos para atender às demandas futuras de expansão bem-sucedida no devido tempo.
Construir uma base sólida no início do ciclo de vida do produto é fundamental para o desenvolvimento bem-sucedido do produto e para fornecer um processo de fabricação robusto e escalável para um novo produto.
Referências
- Diretrizes SUPAC-IR, 1995 (US Food and Drug Administration)
- Diretrizes SUPAC-MR, 1997 (US Food and Drug Administration)
- Diretriz ICH, Desenvolvimento Farmacêutico, Q8(R2), agosto de 2009.
- Programa piloto EMA-FDA para avaliação paralela de aplicativos Quality-by-Design: lições aprendidas e perguntas e respostas resultantes da primeira avaliação paralela. EMA/430501/2013.
- Yu, LX, et al., Understanding Pharmaceutical Quality by Design. The AAPS Journal (2014), 16 (4): 771-783.
- https://www.qualitydigest.com/inside/twitter-ed/taking-holistic-approach-quality-design.html.
- Diretriz ICH, Gerenciamento de riscos de qualidade, Q9, novembro de 2005.
- Diretriz ICH, Sistema de Qualidade Farmacêutica, Q10, junho de 2008.
Autor: Dr. Kashif Ghaffar
Biografia: Kashif Ghaffar é farmacêutico para validação de processos na unidade da Pfizer Freiburg e ingressou na Pfizer em abril de 2020. Nessa função, ele é responsável pela validação, expansão e transferência de produtos. Anteriormente, Kashif foi Gerente de Validação de Processos na Ferring Pharmaceuticals, onde manteve o status de validação e escalonamento de produtos.
Kashif é um farmacêutico licenciado e possui um Ph.D. em Tecnologia Farmacêutica. Durante sua carreira acadêmica na Universidade de Tuebingen, ele acumulou uma ampla experiência em vários processos de fabricação farmacêutica e desenvolvimento de produtos por meio de seu trabalho científico e palestras.
Nenhum comentário:
Postar um comentário