Revitalização de medicamentos mais antigos usando tecnologias de formulação inovadoras pela via regulatória 505(b)(2)
Por Jim Huang, PhD, Fundador e CEO, Ascendia Pharmaceuticals

Reimpresso com permissão de Drug Development & Delivery (www.drug-dev.com)
“De vez em quando, uma nova tecnologia, um velho problema e uma grande ideia se transformam em inovação” – Dean Kamen, inventor do Segway
Mais de 50% dos medicamentos aprovados no mercado contêm APIs pouco solúveis em água, que normalmente estão associados a baixa biodisponibilidade, entrega de medicamentos abaixo do ideal, eficácia ineficaz de medicamentos e efeitos colaterais. 1 Isso cria uma enorme oportunidade na geração de produtos 505(b)(2), que atendem às necessidades médicas não atendidas, aplicando tecnologias de formulação para superar essas dificuldades.
Uma característica chave da via 505(b)(2) é que o patrocinador 505(b)(2) pode confiar em dados clínicos ou literatura produzida por outras empresas. O caminho 505(b)(2) permite que os fabricantes adquiram a aprovação do FDA sem realizar todo o trabalho necessário com um NDA tradicional. A estratégia 505(b)(2) pode ser uma opção para melhorar os medicamentos existentes com uma nova indicação, forma farmacêutica, regime posológico, potência, combinação com outros produtos, nova via de administração, eliminação do efeito alimentar, mudança de prescrição medicamentos (Rx) para um produto de venda livre (OTC), produto sem receita que difere da monografia OTC e indicações de medicamentos órfãos. 2,3
Tanto as empresas de genéricos quanto as de marca estão se voltando para produtos 505(b)(2) mais complexos para evitar a concorrência de genéricos comoditizados. Muitos medicamentos comercializados foram reformulados com sucesso para melhorar a eficácia, segurança e adesão do paciente usando a via regulatória NDA 505(b)(2) ou 505(b)(1) (Tabela 1). A revitalização de medicamentos comercializados mais antigos usando tecnologias ou plataformas inovadoras de distribuição de medicamentos pode fornecer nova exclusividade de marketing e nova proteção de patente e, assim, oferecer uma ferramenta eficaz para o gerenciamento do ciclo de vida do produto.
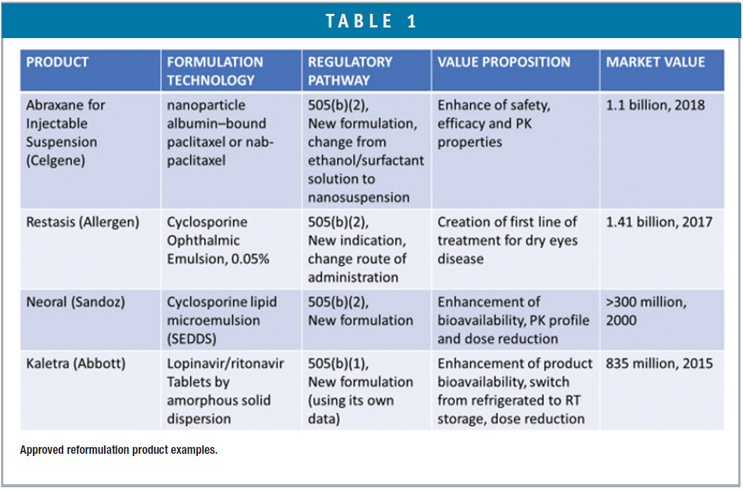
Embora o caminho 505(b)(2) permita o uso de resultados de pesquisa de outros para o envio de NDA, os peticionários do produto 505(b)(2) ainda precisam conduzir sua própria pesquisa, particularmente em CMC ou áreas clínicas, conforme exigido pelo FDA a fim de obter aprovação.3 O desenvolvimento de medicamentos 505(b)(2) envolve uma compreensão completa do DMPK, farmacologia clínica, biologia, propriedades físico-químicas e biofarmacêuticas em relação à dissolução, absorção e processo de disposição do medicamento no corpo enquanto tira proveito das tecnologias de entrega de drogas. Dependendo das propriedades físicas, químicas e biofarmacêuticas de um composto, um projeto de formulação racional deve ser explorado com a orientação de uma árvore de decisão. 4Além disso, entender as vantagens e limitações das tecnologias de entrega de medicamentos no contexto dos perfis farmacêuticos alvo, como indicação do medicamento, regime de dose, população de pacientes, via de administração e estratégia de patentes (Tabela 2), será essencial para um 505 bem-sucedido (b)(2) desenvolvimento de produto certo na primeira vez de forma acelerada e de qualidade.
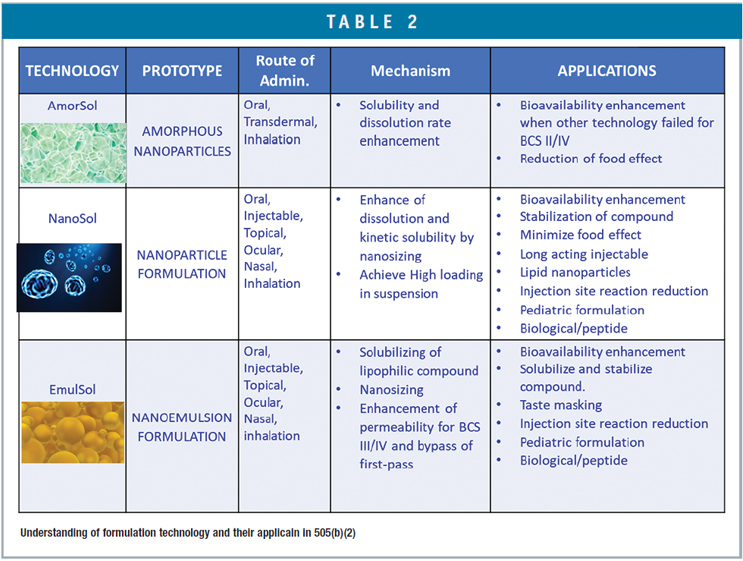
A Ascendia desenvolveu alguns medicamentos patenteados 505(b)(2) usando suas plataformas de nanotecnologias para atender às necessidades médicas não atendidas.
O ASD-002 é uma forma parenteral de nanoemulsão de armazenamento em temperatura ambiente, pronta para uso, de um medicamento antiplaquetário oral de grande sucesso para o tratamento da Síndrome Coronariana Aguda. Quando administrado por via oral, há um atraso significativo no tempo necessário para que o medicamento se torne eficaz - o tempo para atingir o pico de concentração e o efeito terapêutico pode levar várias horas. Portanto, em um cenário de emergência aguda, uma forma de dosagem injetável de ação mais rápida é desejável. A barreira para o desenvolvimento de tal produto injetável é devido à solubilidade altamente desafiadora do composto, forma física e propriedades de estabilidade química. O ASD-002 supera esses desafios de estabilidade e entrega estabilizando o composto por sua formulação de nanoemulsão.
ASD-004 é uma nanoemulsão oftálmica indicada para aumentar a produção de lágrima em pacientes cuja produção de lágrima está supostamente suprimida devido à inflamação ocular associada à ceratoconjuntivite seca. Medicamentos para olhos secos, como a emulsão oftálmica de ciclosporina 0,05%, estão atualmente disponíveis apenas como uma emulsão branca e opaca Restasis) com tamanho médio de 100-200 nm. O mercado de Restasis é estimado entre US$ 870 e US$ 900 milhões em vendas mundiais durante o ano de 2013, tornando-o o medicamento oftálmico mais vendido de longe para a doença do olho seco. Conforme descrito nas informações de prescrição de Restasis, a eficácia de Restasis é moderada: apenas 15% dos pacientes tratados com Restasis demonstraram aumentos estatisticamente significativos na umectação de Schirmer de 10 mm versus 5% dos pacientes tratados com veículo. Em ensaios clínicos, a reação adversa mais comum após o uso de RESTASIS® foi queimação ocular (17%). Portanto, há uma necessidade não atendida de tratar a doença crônica do olho seco que poderia demonstrar melhor resposta e efeitos colaterais reduzidos, como sensação de queimação e visão embaçada, reduzindo o nível de surfactante e aumentando a clareza da formulação. Utilizando a plataforma de tecnologia de nanoemulsão da Ascendia, foi desenvolvido o colírio de nanoemulsão transparente ASD-004. As vantagens potenciais da nova formulação incluem 1) redução significativa no tamanho das gotículas para menos de 100 nm pela nova formulação da Ascendia para administração oftálmica, que deverá aumentar a biodisponibilidade do fármaco e, portanto, a eficácia local nos olhos; 2) a clareza óptica alcançada pela nova abordagem de nanoemulsão pode eliminar o efeito colateral da visão embaçada;
ASD-005 é uma nanopartícula lipídica do tipo lipossoma para liberação sustentada de um bloqueador não seletivo de receptores β e α adrenérgicos pela via parenteral. Atualmente, a droga está disponível apenas em comprimidos orais de liberação imediata duas vezes ao dia e cápsulas orais de liberação controlada uma vez ao dia com vendas de > $ 1 bilhão por ano. Não há forma farmacêutica parenteral disponível no mercado. A administração oral da forma de dosagem oral pode representar um desafio para pacientes sob condições de cuidados agudos com insuficiência auditiva ou hipertensão, porque as formas de dosagem orais normalmente têm um atraso no início do medicamento e um extenso metabolismo de primeira passagem que resulta em uma biodisponibilidade oral de apenas 25%-35%; Além disso, efeitos colaterais como hipotensão com risco de vida associados à forma de dosagem oral são frequentemente relatados em pacientes que tomam esses medicamentos. Portanto, uma formulação parenteral com um início rápido e ainda uma característica de liberação sustentada é desejável para o manejo de pacientes internados com eventos cardiovasculares agudos. As composições contendo carvedilol encapsulado em nanopartículas semelhantes a lipossomas apresentaram maior biodisponibilidade e menor taxa de depuração do que a forma solução após administração intravenosa. A libertação in vitro desses lipossomas em soluções tampão mostra a libertação prolongada do fármaco ao longo de 48 horas e, de forma correspondente, os dados animais in vivo mostram que a administração parentérica do fármaco encapsulado em materiais lipídicos tem um perfil PK de libertação sustentada. As composições contendo carvedilol encapsulado em nanopartículas semelhantes a lipossomas apresentaram maior biodisponibilidade e menor taxa de depuração do que a forma solução após administração intravenosa. A libertação in vitro desses lipossomas em soluções tampão mostra a libertação prolongada do fármaco ao longo de 48 horas e, de forma correspondente, os dados animais in vivo mostram que a administração parentérica do fármaco encapsulado em materiais lipídicos tem um perfil PK de libertação sustentada. As composições contendo carvedilol encapsulado em nanopartículas semelhantes a lipossomas apresentaram maior biodisponibilidade e menor taxa de depuração do que a forma solução após administração intravenosa. A libertação in vitro desses lipossomas em soluções tampão mostra a libertação prolongada do fármaco ao longo de 48 horas e, de forma correspondente, os dados animais in vivo mostram que a administração parentérica do fármaco encapsulado em materiais lipídicos tem um perfil PK de libertação sustentada.
REFERÊNCIAS
- FORUM DE FORMULAÇÃO - Abordagens de formulação sofisticadas para candidatos a medicamentos insolúveis, por Jim Huang, Drug Development & Delivery, março de 2019, Vol19 No 1. https://drugdev.com/formulation-forum-sofisticated-formulation-approaches-for-insoluble-drug -candidatos/.
- Orientação para a indústria: aplicativos cobertos pela seção 505(b)(2), https://www.fda.gov/downloads/Drugs/Guidances/ucm079345.pdf.
- Orientação para o setor: Determinando se deve enviar uma solicitação ANDA ou 505(b)(2); https://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM579751.pdf.
- FORUM DE FORMULAÇÃO – Estratégia de Pesquisa de Formulação para Candidatos a Novos Medicamentos em Estágio de Descoberta, por Jim Huang et al. Março de 2019, Vol19 No2. https://drug-dev.com/formulation-forum-formulation-research-strategy-for-discovery-stage-new-drug-candidates/.
Nenhum comentário:
Postar um comentário