Desenvolvimento de Formulação Pediátrica Adequada à Idade
Por Jim Huang, PhD, Fundador e CEO, Ascendia Pharmaceuticals

Reimpresso com permissão de Drug Development & Delivery (www.drug-dev.com)
FUNDO
Pacientes pediátricos são definidos como pacientes com idade desde o nascimento até menos de 16 ou 18 anos, dependendo do país. A diretriz da UE sobre investigação clínica de medicamentos na população pediátrica (CPMP/ICH/2711/99) usa os seguintes grupos etários em relação aos estágios de desenvolvimento.
- Recém-nascidos prematuros
- Recém-nascidos a termo (0-27 dias)
- Bebês e crianças pequenas (1 mês a 23 meses)
- Crianças (2-11 anos)
- Adolescentes (12-16 ou 18 anos)
Foi reconhecido que os requisitos de formulação de medicamentos para crianças são diferentes dos de adultos. A falta de formulações pediátricas adequadas é o principal obstáculo para o uso de muitos medicamentos em crianças. Historicamente, as crianças têm sido tratadas com medicamentos de uso off-label por meio de manipulação extemporânea, o que, no entanto, não é o ideal devido a potenciais preocupações de segurança/eficácia. Como resultado do US Best Pharmaceuticals for Children Act (BPCA) e do Pediatric Research Equity Act (PREA) de 2007 e de medicamentos da União Europeia para uso pediátrico em 2006, mais e mais empresas são incentivadas a desenvolver e gerar dados clínicos para a pediatria. população, a fim de obter aprovação acelerada de medicamentos e exclusividade de mercado estendida. O desenvolvimento de formulações pediátricas pode ser desafiador devido aos requisitos específicos da população de pacientes. Uma formulação pediátrica deve considerar os seguintes fatores: diferença na fisiologia e farmacocinética das populações de pacientes, seleção da forma de dosagem, via de administração, precisão da dose, flexibilidade da dose, tolerabilidade da droga e do excipiente (segurança e toxicidade), adesão do paciente (palatabilidade/deglutição), estabilidade e acessibilidade aos medicamentos.
CONSIDERAÇÕES BIOFARMACÊUTICAS E ESTRATÉGIA DE DESENVOLVIMENTO CLÍNICO
Uma das questões mais importantes no desenvolvimento de medicamentos para pacientes pediátricos é a seleção da formulação mais adequada em relação à idade do paciente. Devido a mudanças substanciais no perfil de absorção, distribuição, metabolismo e excreção (ADME) em populações pediátricas, particularmente durante os primeiros anos de vida, há uma variabilidade significativa na farmacocinética do mesmo medicamento e forma farmacêutica entre o pediátrico e o adulto. populações. Por exemplo, devido à imaturidade da população pediátrica, a mucosa intestinal de lactentes e crianças pequenas é mais permeável que a de adultos; como resultado, há uma absorção significativamente maior para a população pediátrica do que para os adultos. Além disso, os fatores que afetam a biodisponibilidade do fármaco, como o pH gastrointestinal,
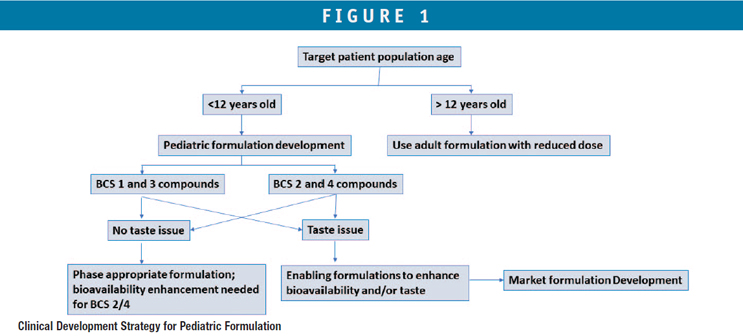
Uma árvore de decisão na estratégia de formulação clínica, com base na classificação BCS do medicamento, idade e palatabilidade do medicamento, é ilustrada na Figura 1 como um guia para o desenvolvimento de formulações pediátricas. Uma estratégia de formulação de habilitação apropriada para a fase pode ser adaptada se o composto for BCS classe 1 ou 3 e não apresentar problemas de palatabilidade. No entanto, para um composto BCS 2 e 4 com problemas de palatabilidade, o desenvolvimento de uma imagem de mercado/formulação comercial é desejado para evitar risco biofarmacêutico em BA/BE entre formulações clínicas e de mercado. Normalmente, os estudos iniciais de uma formulação pediátrica são feitos em uma população adulta para demonstrar BABE aceitável; uma vez demonstrada a segurança e eficácia da formulação em adultos, podem ser realizados ensaios clínicos em crianças com as formulações pediátricas.
SELEÇÃO DA FORMA DE DOSAGEM
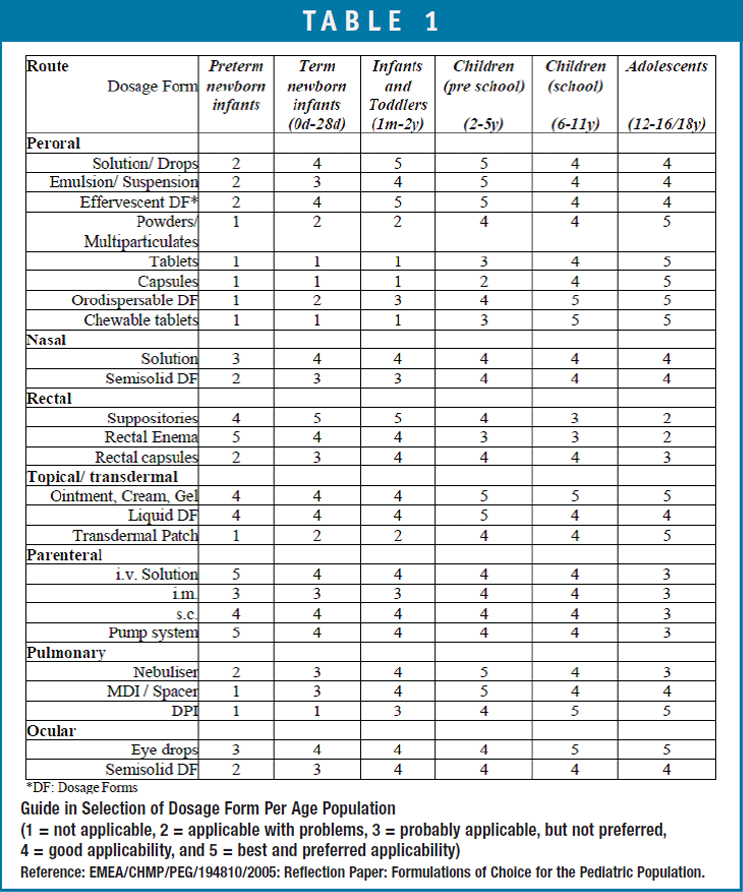
Uma das questões mais importantes no desenvolvimento de medicamentos para pacientes pediátricos é sua adequação à idade do paciente alvo sem apresentar problemas de palatabilidade e deglutição. De acordo com a diretriz da UE sobre a investigação clínica de medicamentos na população pediátrica (CHMP/ICH/2711/99), foi desenvolvida uma matriz combinando diferentes faixas etárias, vias de administração e formas farmacêuticas para auxiliar na seleção da forma farmacêutica. Tabela 1). A classificação etária foi ainda dividida em crianças pré-escolares (2-5 anos) e crianças em idade escolar (6-12 anos) devido às mudanças significativas na capacidade de lidar com algumas formas farmacêuticas entre 2-12 anos de idade.
CONSIDERAÇÕES DE SEGURANÇA EXCIPIENTES
Além da incompatibilidade de excipientes com API que geram impurezas tóxicas, as interações de determinados excipientes em ambientes intracelulares também podem produzir metabólitos tóxicos que podem interferir nos processos de desenvolvimento infantil. É fundamental que a quantidade de atualização diária de excipientes em uma formulação pediátrica esteja dentro da ingestão diária permitida dos excipientes e esteja dentro do limite de produtos pediátricos previamente aprovados nos principais mercados farmacêuticos, como os EUA e a UE.
Embora os excipientes sejam geralmente considerados inertes, há casos em que os excipientes podem desempenhar um papel no aumento da solubilidade e biodisponibilidade e, portanto, impactar na segurança e eficácia do medicamento. Particularmente para recém-nascidos e lactentes, por terem sistemas metabólicos imaturos, a própria droga ou metabólitos tóxicos podem se acumular dentro do corpo causando efeitos colaterais. Os excipientes associados à potencial toxicidade em formulações pediátricas orais, tópicas e intravenosas são: propilenoglicol usado como solvente, que pode causar efeitos no sistema nervoso central (SNC), principalmente em neonatos e crianças menores de 4 anos; o etanol como solvente pode causar intoxicação devido à sua facilidade de atravessar a BBB; álcool benzílico como solvente e conservante tem “síndrome de Gasping” em recém-nascidos; ácido benzóico como conservante pode causar icterícia em recém-nascidos; os parabenos usados como conservantes podem gerar efeitos estrogênicos e reprodutivos potenciais; o sorbitol como adoçante causa desconforto GI como resultado de diarreia osmótica; sacarina como adoçante e corantes como corantes podem induzir reações de hipersensibilidade e fotossensibilidade, etc. Esses excipientes devem ser usados com cautela em pacientes muito jovens.
Em geral, os seguintes aspectos devem ser considerados ao selecionar excipientes para uso em formulações pediátricas: 1) a função do excipiente; 2) o perfil de segurança do excipiente para crianças no(s) grupo(s) etário(s) alvo com base na exposição única e diária; 3) a duração prevista do tratamento (curto ou longo prazo); 4) a gravidade da condição a ser tratada (relação risco/benefício); 5) a aceitabilidade do paciente (palatabilidade/deglutição), etc.
CONSIDERAÇÕES DE FORMULAÇÃO
Idealmente, uma formulação pediátrica deve ser uma forma de dosagem flexível, de bom gosto e subdivisível que seja uma forma oral dispersível, líquida oral ou grânulos que possam ser borrifados em alimentos ou bebidas infantis. Deseja-se que os medicamentos pediátricos permitam uma dosagem flexível e precisa para crianças em diferentes estágios de desenvolvimento com dificuldades de deglutição. As formulações pediátricas também devem ser desenvolvidas com sabor, cor e textura aceitáveis para crianças de diferentes idades e culturas. O mascaramento do sabor é um dos maiores desafios no desenvolvimento de formulações pediátricas, que pode ser alcançado revestindo o API, complexando o API com excipientes, por exemplo, polímeros, e adicionando adoçantes e aromatizantes à formulação. Antes de um painel de sabor humano para avaliação da palatabilidade da formulação,
A maioria das formulações pediátricas são formas farmacêuticas líquidas, incluindo soluções, micro ou nanosuspensões, emulsões, xaropes e, menos frequentemente, elixires com um volume de dosagem direcionado de
Do ponto de vista da qualidade do produto, solventes residuais, metais pesados, impurezas potencialmente genotóxicas, degradantes de incompatibilidades de drogas/excipientes e impurezas de excipientes devem ser controlados para produtos pediátricos. Além disso, deve-se estar ciente de que em algumas partes do mundo, principalmente em áreas tropicais, a refrigeração pode não estar disponível, e os climas apresentam altas temperaturas e níveis de umidade que podem afetar a estabilidade química e física do produto. A embalagem à prova de crianças é necessária e os dispositivos de dosagem (conta-gotas, copos medidores, pipetas graduadas) devem ser avaliados como parte do desenvolvimento do produto pediátrico.
RESUMO
A falta de formulações pediátricas adequadas é o principal obstáculo para o uso de muitos medicamentos em crianças. As formulações pediátricas possibilitam medicamentos de precisão e personalizados para crianças, o que também pode beneficiar os fabricantes de medicamentos com aprovação acelerada de medicamentos e exclusividade de mercado estendida. O desenvolvimento de formulações pediátricas pode ser desafiador devido aos requisitos específicos da população de pacientes. Uma formulação pediátrica deve considerar os seguintes fatores: diferença na fisiologia e farmacocinética das populações de pacientes, seleção da forma de dosagem, via de administração, precisão da dose, flexibilidade da dose, tolerabilidade da droga e do excipiente (segurança e toxicidade), adesão do paciente (palatabilidade/deglutição), estabilidade e acessibilidade aos medicamentos.
Nenhum comentário:
Postar um comentário