Quality by Design aplicado ao desenvolvimento de cápsulas de gelatina mole
A pandemia que vivemos nos fez perceber o impacto e a necessidade de medicamentos na vida dos pacientes. Essas, por sua vez, são substâncias que contêm em sua composição fármacos, os chamados princípios ativos responsáveis pelo alívio de diversos sintomas. Nesse sentido, o artigo abordará alguns aspectos fundamentais da qualidade by design aplicada ao desenvolvimento de cápsulas moles, preconizando que pensemos no paciente e na qualidade não como uma linha de chegada, mas como um ponto de partida ao longo do ciclo de vida do produto, o que certamente impulsiona a inovação e a adaptabilidade à mudança, afinal, a mudança é a única constante! Vale lembrar que a indústria farmacêutica é sem dúvida uma das que mais investe em Pesquisa & Desenvolvimento de forma global, impulsionando cada vez mais o mundo por meio da inovação,

O desenvolvimento farmacotécnico de medicamentos envolve fatores inerentes à tecnologia de produção e controle de qualidade, garantindo segurança e eficácia terapêutica. No entanto, a eficácia clínica de um medicamento não é atribuída apenas à sua atividade farmacológica intrínseca, portanto, a avaliação dos aspectos relacionados às propriedades físico-químicas e farmacocinéticas dos princípios ativos farmacêuticos, aos excipientes utilizados na formulação e ao processo de fabricação e a tecnologia é considerada indispensável para alcançar o sucesso e garantir a biodisponibilidade in vivo.
É fundamental esclarecer que a qualidade na indústria farmacêutica só pode ser considerada adequada se atuar preventivamente; ou seja, deve evitar a ocorrência de falhas. Por isso, a única maneira de fazer isso é por meio do gerenciamento de riscos. Este pode ser caracterizado como um processo de seleção de medidas de prevenção e controle de problemas com base em uma avaliação de risco, visando melhorar a tomada de decisão, reduzir a subjetividade, estabelecer métodos bem estabelecidos e, acima de tudo, dar confiança aos órgãos reguladores.
Por outro lado, instituir um processo como esse exigirá tempo, confiança e comunicação entre as áreas e, na minha opinião, a mudança de mentalidade da empresa será a mais impactada. Portanto, o maior desafio é fazer com que os envolvidos entendam de forma tangível o valor que a análise de risco tem. Quando realizada de forma eficiente, mapeando os processos, avaliando os riscos envolvidos em cada etapa, definindo seus efeitos e as ações de mitigação ou controle de riscos, esta ferramenta é, sem dúvida, de grande valor para a empresa [1].
Vale ressaltar que o trabalho é árduo e o retorno não é imediato; porém, no médio e longo prazo, a implantação da chamada cultura da qualidade gera retornos eficazes e de alto impacto, como redução de retrabalho, mitigação de falhas em processos e produtos, aumento de produtividade e, significativamente, aumento de credibilidade das empresas perante seus clientes principais, o principal, o paciente.
Além disso, possibilita a redução de erros, melhorando a eficiência da fabricação e gerando economia para a indústria, além de melhorar a qualidade do produto, evitando em muitos casos até o recall de produtos, além de decisões baseadas na ciência baseada no risco, com a promoção de uma abordagem multidisciplinar nos setores envolvidos, pois pode potencializar o incentivo à abordagem preventiva em todos os processos, conseguindo agregar valor ao produto, evitando a aplicação de medidas restritivas e desnecessárias. Para atingir essa meta de qualidade de forma confiável, deve haver um sistema de qualidade farmacêutica abrangente e adequadamente implementado que incorpore o gerenciamento de risco [2].
No que diz respeito aos produtos farmacêuticos, embora existam várias partes interessadas, incluindo farmacêuticos, médicos e enfermeiros, a proteção do paciente deve ser considerada de extrema importância. Portanto, a qualidade deve ser um requisito essencial nas instalações de saúde, onde a gestão de riscos deve vir de cima para baixo. A liderança precisa acreditar na sua importância, se comprometer a replicar essa cultura em toda a instituição e fazer com que todos os envolvidos sigam os processos da carta.
Perspectiva da indústria e implementação de QbD
Do ponto de vista da indústria farmacêutica, QbD requer o desenvolvimento de uma compreensão científica fundamental dos processos críticos e atributos do produto, o estabelecimento de controles de design e testes com base na qualidade do produto e dentro dos limites da compreensão científica e uso do conhecimento adquirido ao longo do ciclo de vida de um produto operar em um ambiente de melhoria contínua.
A implementação do conceito de Quality by Design (QbD) propõe uma abordagem sistemática para o desenvolvimento, começando com objetivos predefinidos enfatizando a compreensão do produto e o controle do processo. Com base na abordagem científica e na gestão do risco de qualidade, com foco no ciclo de vida do produto, pelo qual este passa, desde o início do desenvolvimento, comercialização até a sua descontinuação, tendo diversos clientes (stakeholders) - cada um com necessidades e expectativas específicas, causando impacto prático no planejamento estratégico da empresa. Permitindo organizar ideias e tomar decisões com mais assertividade e criatividade, direcionando inovação e produto centrados no paciente, gerando valor e oferecendo soluções de curto, médio e longo prazo para o negócio [3].
Colocar o usuário no centro do processo torna mais fácil perceber que o valor da inovação às vezes pode estar nos detalhes, porque esse conceito busca evidências em lugares onde nem todos olham. Muitas empresas superestimam a inovação tecnológica, comprando novas máquinas e modernizando demais os parques industriais, mas esquecem que a inovação também diz respeito às pessoas. Assim, esse conceito ajudará os gestores a compreender que inovação é, antes de tudo, o que impacta a vida dos pacientes, seguindo o pilar da empresa, valorizando o ser humano e respeitando suas diferenças.

A aplicação do conceito e consolidação da equipe, a realização do relatório de desenvolvimento do produto farmacêutico e a qualificação do desempenho do processo. Além disso, para possibilitar o scale-up da produção de forma mais potente e sua verificação contínua (do registro ao lançamento do produto), e paralelamente a essas atividades, serão ministrados treinamentos sobre o tema para estabelecer a nova cultura na empresa, pois focar nas necessidades dos clientes e nos seus desejos naturais, em constante transformação, demonstra que é possível ousar e inovar, de forma rápida e bem feita.
O setor farmacêutico está em constante evolução. A harmonização dos padrões de produção para garantir a eficácia, segurança e qualidade dos medicamentos é um dos maiores desafios. Nessa abordagem, a qualidade é inversamente proporcional à variabilidade, e a implementação do conceito QbD é uma ferramenta promissora para a indústria farmacêutica, pois permite a produção de medicamentos por meio de predição de risco, possibilitando redução de custos. A implementação deste conceito requer novas tecnologias e tecnologias, uma mudança no conceito de qualidade da empresa [4].
Qualidade por definição de design
Quality by Design (QbD) fornece uma abordagem científica, baseada no risco, holística e proativa para o desenvolvimento / compreensão do produto aprimorado (formulação do produto, processo e dispositivo) e garante a qualidade desejada do produto consistente, incluindo desempenho ao longo do ciclo de vida do produto, incluindo melhoria contínua .
- O Perfil de Produto Alvo de Qualidade (QTPP) descreve os critérios de design para o produto e deve, portanto, formar a base para o desenvolvimento de CQAs, CPPs e estratégia de controle.
- Atributos Críticos de Qualidade (CQA): Uma propriedade ou característica física, química, biológica ou microbiológica que deve estar dentro de um limite, faixa ou distribuição apropriada para garantir a qualidade desejada do produto.
- Parâmetro Crítico de Processo (CPP): Um parâmetro de processo cuja variabilidade afeta um CQA deve ser monitorado ou controlado para garantir que o processo produza a qualidade desejada.
- Atributo de material crítico (CMA): Uma propriedade ou característica física, química, biológica ou microbiológica de um material de entrada dentro de um limite, faixa ou distribuição apropriada para garantir a qualidade desejada do material de saída.
Qualidade por Princípios de Design
Qualidade alvo: um objetivo compartilhado nos resultados do projeto e nas especificações do produto.
Design: QbD já começa na fase inicial e se intensifica ao longo do aumento de escala do projeto. Princípios fundamentais:
- Deve ser reconhecido pela Alta Administração como forma de condução de projetos.
- QbD é realizado em equipe, em grupos diversos, incluindo o cliente, quebrando silos, especialistas em processos e novos olhos.
- QbD é um investimento na startup, gerando conhecimento valioso sobre o produto e reduzindo riscos e cronogramas globais.
Visão geral: expectativa regulatória
É imprescindível destacar que após a publicação da RDC 301/2019, que apresenta as Boas Práticas de Fabricação (BPF) de produtos farmacêuticos, a análise de risco tem recebido mais atenção dos profissionais desta área, sendo considerada um requisito essencial para a avaliação do processo de fabricação do medicamento. No âmbito internacional, o guia ICH Q9 trouxe de forma mais tangível a implementação da gestão de riscos na indústria farmacêutica, tornando-se mais científica, sendo um componente essencial na manutenção da qualidade ao longo do ciclo de vida dos produtos, permitindo a pesquisa e avaliação risco em todas as etapas das atividades fabris.
Assim, devemos pensar no paciente e na qualidade como uma atitude contínua, não um acontecimento episódico! Pelo exposto, estou plenamente convencido de que a mudança deve ser cultural, onde o foco deve ser a qualidade para garantir essa mudança de paradigma. Medicamentos reproduzíveis de fabricação que são seguros e eficazes.
A Food and Drug Administration (FDA) dos EUA incentiva abordagens baseadas em risco e a adoção dos princípios QbD no desenvolvimento, fabricação e regulamentação de medicamentos. A ênfase do FDA em QbD começou com o reconhecimento de que o aumento dos testes não melhora necessariamente a qualidade do produto, e a qualidade deve ser incorporada ao produto.
O conceito e a definição de Perfil de Produto Alvo de Qualidade (QTPP), Atributo de Qualidade Crítico (CQA), Parâmetros de Processo Crítico (CPPs), Espaço de Projeto e estratégia de Controle são descritos em:
- ICH Q8 Pharmaceutical Development [5].
- ICH Q9 Quality Risk Management [6].
- Sistema de qualidade farmacêutica ICH Q10 [7].
- Orientação da FDA para a indústria: validação de processo.
- Diretriz da EMA sobre validação de processos.
- RDC nº 301/2019 - ANVISA.
As etapas da Qualidade por Design
Ele começa com o “perfil de produto alvo (TPP)”, que descreve o uso, segurança e eficácia do produto [8].
O “perfil do produto alvo de qualidade”, que descreve as informações quantitativas sobre a segurança e eficácia clínica durante o estágio de desenvolvimento do produto, é definido e usado pelo pessoal de formulação e processo.
O conhecimento do ingrediente ativo, das substâncias potencialmente inativas e das operações do processo são coletados em um espaço de conhecimento. Se mais pesquisas forem necessárias, a avaliação de risco é feita para prever as lacunas no conhecimento.
As formulações e “atributos de material (qualidade) críticos” do produto acabado, que devem ser controlados, são definidos para atender ao perfil de produto de qualidade alvo.
Seguindo o processo de manufatura do produto do qual os atributos materiais críticos são determinados, um Espaço de Projeto ou outra representação do entendimento do processo é estabelecido combinando experiências com conhecimento prévio para utilizar outras ferramentas.
Uma “estratégia de controle” é criada para todo o processo, incluindo controles de material de entrada, controles de processo, monitoramento, espaços de design em torno de uma ou várias operações de unidade e / ou teste de produto acabado. A estratégia de controle deve incluir as mudanças esperadas na escala, e a avaliação de risco pode guiar a estratégia de controle.
Em seguida, é feito o monitoramento e o processo é atualizado para garantir a sustentabilidade da qualidade.
Resultado de QbD
O risco de atraso no registro e lançamento também pode afetar o sucesso financeiro de um produto comercializado. A pesquisa mostra que um produto que está seis meses atrasado para o mercado perde um terço do lucro potencial ao longo do ciclo de vida do produto e que a implementação do conceito QbD pode diminuir os custos de desenvolvimento em até 50 por cento e os custos de produção em 9 por cento, permitindo lucros para aumento de 22 por cento [9].
Qualquer redução no período total de descoberta de medicamentos no mercado deve melhorar a lucratividade da empresa. A este respeito, as empresas farmacêuticas estão se concentrando em estratégias para otimizar o ciclo de vida do produto, uma vez que lhes permite maximizar o crescimento inicial do produto no mercado, sustentar o pico de vendas enquanto o produto é patenteado e atrasar o declínio pós-expiração da patente para Assim que possível. Isso deve aumentar o retorno sobre o investimento ao longo do ciclo de vida de um produto, permitindo que a empresa recupere os custos de desenvolvimento e faça mais investimentos em P&D.
Ao colocar o QbD em prática, ele se disseminará como um recurso estratégico capaz de posicionar vantagens competitivas em relação ao mercado, ou seja, um modelo de pensamento centrado no cliente que busca soluções inovadoras e significativas. Com uma abordagem orientada para o paciente, este conceito é estruturado pelos pilares Empatia, Colaboração, Pesquisa e Experimentação.
A prática está no desenvolvimento e fabricação de produtos e nos processos estratégicos adotados ao longo do ciclo de vida do produto. Isso permitirá à empresa inovar em diferentes setores e áreas de mercado, com o objetivo de desenvolver ideias que melhorem a função, o valor e a aparência dos produtos para o benefício mútuo do cliente e do Grupo Procaps.
Vantagens do aplicativo QbD

As principais vantagens da aplicação QbD incluem [10]:
- Diminui os problemas de estabilidade.
- Aumente a assertividade do processo.
- Aumente a rastreabilidade.
- Minimize o número de reprocessos.
- Aumenta a eficiência no estágio de bancada.
- Menor custo de desenvolvimento.
- Diminui os problemas enfrentados no estágio de aumento de escala.
- Cumprimento dos objetivos do projeto.
- Necessidade de adequação regulatória (GMP).
- Maximização do retorno do investimento.
- Maior controle dos gastos do projeto.
- Aumenta a segurança e eficácia do medicamento.
- Uma abordagem sistemática para o desenvolvimento.
- Melhor conhecimento do processo.
- Menos ciclos de revisão, aprovação de revisão mais rápida.
- Viabilidade da indústria farmacêutica e mudança de cultura.
Desafios para o aplicativo QbD
Desafios críticos para o aplicativo QbD incluem:
- Identifique riscos genuínos com base em uma abordagem científica.
- Aplicativo aberto do QbD para a execução da abordagem de ação.
- Encontrar o equilíbrio certo entre a abordagem clássica e QbD em relação à viabilidade comercial,
- Valiosos conhecimentos gerados e como compartilhá-los e mantê-los vivos.
Softgels
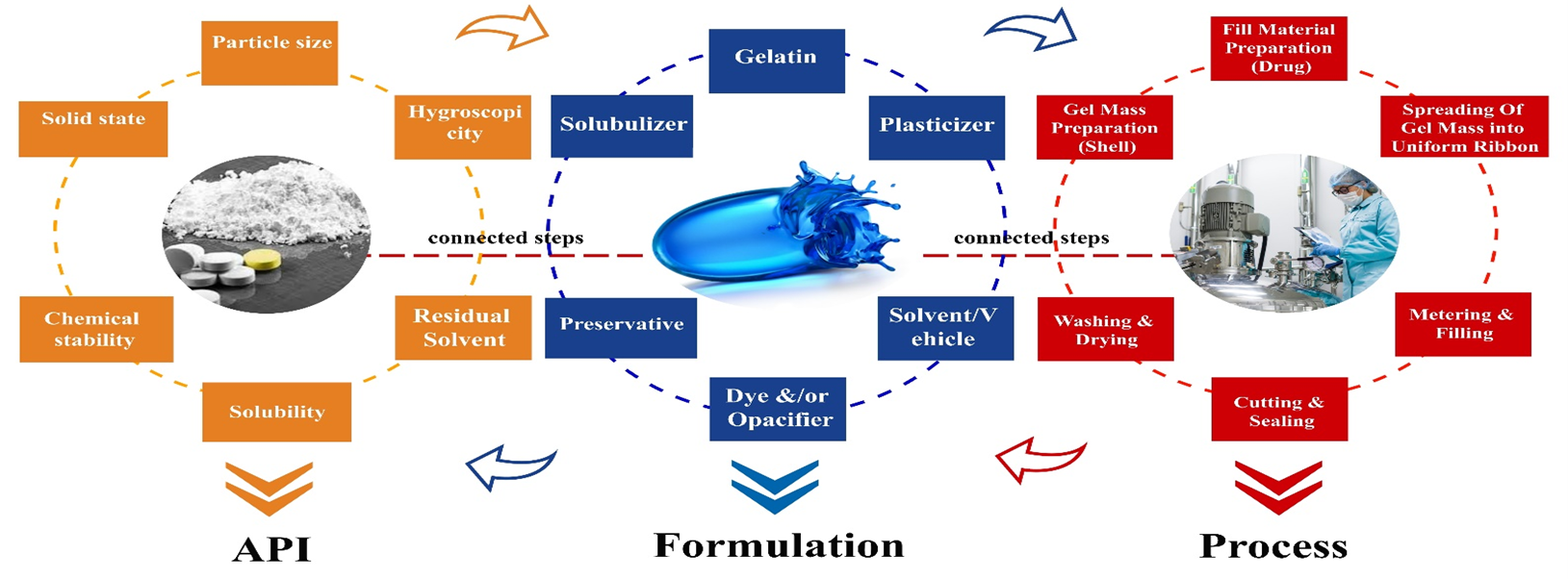
As cápsulas de gelatina mole (cápsulas moles ou elásticas / cápsulas moles) consistem em conchas moles hermeticamente seladas. As cápsulas de gelatina mole são preparadas adicionando um plastificante, como glicerina ou álcool poli-hídrico (por exemplo, sorbitol), à gelatina, e o plastificante torna a gelatina elástica. As cápsulas de gelatina mole vêm em vários formatos, como tubos esféricos, elípticos, oblongos e especiais com e sem torções. Eles podem conter líquidos não aquosos, suspensões ou materiais pastosos. Eles são essenciais para conter substâncias medicamentosas voláteis ou suscetíveis à degradação na presença de ar [11,12].
Estes, por sua vez, são formados pelo processo de matriz rotativa. Dependendo do polímero que forma a casca, eles podem ser subdivididos em cápsulas de gelatina mole ou não gelatinosa. A maioria das cápsulas moles é feita de gelatina devido às propriedades físicas únicas que as tornam um excipiente ideal para o processo de matriz rotativa. As cápsulas moles baseadas em alternativas não gelatinosas são derivadas de plantas e / ou sintéticas [13].
O invólucro de uma cápsula de softgel consiste em gelatina, um plastificante ou uma combinação de plastificantes e água. Além disso, pode conter conservantes, corantes, opacificantes, aromatizantes e adoçantes, possivelmente açúcar para conferir características mastigáveis, substâncias gastro-resistentes e, em casos excepcionais, até mesmo compostos ativos. A água serve como solvente para formar uma massa de gelatina derretida com viscosidade de fluido a 60-70 ° C. A proporção em peso de água para gelatina seca pode variar de 0,7 a 1,3, dependendo da viscosidade da gelatina sendo usada. Após a formação da cápsula, a maior parte da água é removida por secagem, resultando em cápsulas com um teor de água residual em torno de 4-10% [13].
As cápsulas de gelatina consistem em uma matriz líquida ou semissólida dentro de uma camada externa de gelatina inteiriça. O próprio composto de droga pode estar em solução ou suspensão na matriz de enchimento da cápsula. As características da matriz de enchimento podem ser hidrofílicas (por exemplo, polietilenoglicol), lipofílicas (por exemplo, óleos vegetais triglicerídeos) ou uma combinação de ingredientes hidrofílicos e lipofílicos [14]. Ingredientes que são sólidos à temperatura ambiente também podem ser encapsulados em cápsulas moles, desde que sejam pelo menos semissólidos abaixo de cerca de 40 ° C.
Por sua vez, esse tipo de forma farmacêutica apresenta diversas vantagens, entre elas: facilidade de deglutição; o volume preciso da unidade de enchimento de líquido oferece maior precisão e consistência da cápsula lote a lote; requisitos de fabricação consistentes: composição de enchimento líquido mais precisa, mistura e distribuição facilitam a fabricação; as misturas líquidas são mais homogêneas; biodisponibilidade aumentada: a absorção e a biodisponibilidade podem ser aumentadas pela formulação de compostos em solução, incluindo solubilizantes e intensificadores de absorção, se necessário; os fármacos insolúveis em água podem ser formulados em cápsulas moles; maior estabilidade e segurança: vedação hermética protege do ar e contaminação cruzada; a casca de gelatina pode ser formulada para bloquear a luz ultravioleta; a flexibilidade permite formas e tamanhos personalizados adequados para administração oral, tópica, mastigável e supositório;
A fabricação é um processo simples com menos etapas do que outras tecnologias orais sólidas, tornando-o direto para aplicações QbD. Os princípios QbD são prontamente aplicáveis aos conceitos de produtos de cápsulas moles, começando com o projeto e iterando ao longo de todo o ciclo de vida do projeto. Os projetos podem ser recebidos em qualquer estágio de desenvolvimento e progresso com uma abordagem baseada no risco.
Será dada ênfase aos diferentes Atributos Críticos de Qualidade (CQAs) que devem ser avaliados como parte da estratégia QbD (Quality by Design) durante o desenvolvimento de medicamentos contendo gelatina.
Conclusão
Portanto, concluímos que o desenvolvimento farmacêutico baseado na abordagem do ciclo de vida do produto deve ser realizado sob os conceitos e princípios mencionados anteriormente, incorporando as Boas Práticas de Fabricação (BPF), atendendo às expectativas dos órgãos reguladores. Dessa forma, a qualidade deve ser controlada em cada etapa do processo para maximizar a probabilidade de o produto chegar ao paciente atingindo seus atributos e especificações de qualidade, considerando todos os envolvidos: equipe multidisciplinar, fornecedores e cliente final.
O Quality by Design se destina a aprimorar o conhecimento do processo e é baseado em orientações e documentos de referência existentes. Pode ser visto como um processo definido pelos requisitos do documento de acordo com o conhecimento e compreensão do processo. Ele pode ser aplicado a produtos antigos e novos, mas o pacote de documentos de suporte pode ser diferente. O pacote de documentos QbD está "vivo". Eles podem e devem ser revisados conforme a base de conhecimento muda. A implementação do QbD farmacêutico visa reduzir a variabilidade e os defeitos do produto, melhorando assim o desenvolvimento do produto e as eficiências de fabricação e o gerenciamento de alterações pós-aprovação.
Por fim, o QbD é um desafio de implementação do ponto de vista da indústria porque ainda não adotou totalmente sua aplicação para o desenvolvimento de produtos farmacêuticos. Dada a necessidade de mapear e controlar os riscos observados ao longo do ciclo de vida do produto, porém, aplicando esse conceito, sem dúvida haverá uma melhora significativa na qualidade e eficácia do medicamento no que diz respeito ao tratamento do paciente.
 Baixe o artigo completo em PDF aqui
Baixe o artigo completo em PDF aqui
Informação do artigo: Antraco, VJ; Quality by Design aplicado ao desenvolvimento de cápsulas de gelatina mole. PharmaExcipients 2021 .
Fonte

Vitor Jacó Antraco é analista sênior de desenvolvimento farmacêutico da Softigel by Procaps Group. Tel: + 55113405-5858. É mestre em bioquímica metabólica / molecular pela Universidade Federal de São Paulo (UNIFESP) e mestre em Administração de Empresas pela Fundação Getúlio Vargas (FGV) em Gestão em Saúde e bacharel em farmácia / bioquímica pela Universidade Presbiteriana Mackenzie. Atuou nas áreas de Oncologia / Hematologia Hospitalar, Garantia de Qualidade / Validação, Desenvolvimento Galênico e Desenvolvimento Farmacotécnico. -R e D.
Referências
- Junker, BH Construindo um Caso de Negócio para Implementação Biofarmacêutica QbD (Revisão por Pares). 2012
- Yu, LX; Amidon, G .; Khan, MA; Hoag, SW; Polli, J .; Raju, GK; Woodcock, J. Understanding Pharmaceutical Quality by design. AAPS J. 2014, 16, 771–783, doi: 10.1208 / s12248-014-9598-3.
- Calcott, PH How QbD, e as Orientações de Validação de Processo do FDA afetam o desenvolvimento e as operações do produto, parte. Bioprocess Int. 2011, 9, 12–17.
- Sangshetti, JN; Deshpande, M .; Zaheer, Z .; Shinde, DB; Arote, R. Quality by design approach: Regulatory need. Árabe. J. Chem. 2017, 10, S3412 – S3425.
- Diretriz, ICHHT Desenvolvimento farmacêutico. Q8 (2R). Quanto a Revis. Agosto de 2009.
- Diretriz, ICHHT Gestão de risco de qualidade. Q9, Curr. etapa 2005, 4, 408.
- (ICH), IC on H. ICH Harmonized Tripartite Guideline: Pharmaceutical Quality System Q10 (versão atual da etapa 4). 2008
- Mesut, B .; Zsoy, Y .; Aksu, B. O lugar dos parâmetros de qualidade críticos de produtos farmacêuticos na qualidade desde o projeto (QbD). Turk J Pharm Sci 2015, 12, 75–92.
- Fuhr, T .; Holcomb, M .; Rutten, P. Por que a qualidade por design deve estar na agenda da equipe executiva. Dev. Nova estratégia. Novos tempos. Mckinsey Co. 2009, 195–203.
- Nadpara, NP; Thumar, R. V; Kalola, VN; Patel, PB Quality by design (QBD): Uma revisão completa. Int J Pharm Sci Rev Res 2012, 17, 20–28.
- Gullapalli, RP Cápsulas de gelatina mole (cápsulas moles). J. Pharm. Sci. 2010, 99, 4107–4148.
- Augsburger, LL; Hoag, SW Formas de dosagem farmacêutica: cápsulas; CRC Press, 2017; ISBN 1841849774.
- Reich, G. Formulação e propriedades físicas de cápsulas moles. Pharm. Capsul. Pharm. Pressione. Londres 2004, 201–212.
- Aulton, ME; Taylor, K. Aulton's Pharmaceutics: the design and manufacturing of medicine; Elsevier Health Sciences, 2013; ISBN 0702042900.