Seleção de tecnologia para aumento da biodisponibilidade
Por David K. Lyon, Ph.D., pesquisador sênior, pesquisa

O aumento da prevalência em pipelines farmacêuticos de compostos ativos com baixa solubilidade levou à proliferação de abordagens para aumentar a absorção de drogas orais e a biodisponibilidade. A seleção da tecnologia adequada pode fazer a diferença entre o sucesso ou o fracasso do desenvolvimento.
A seleção cuidadosa da tecnologia certa para aumentar a biodisponibilidade e a absorção oral do medicamento é essencial nos programas de desenvolvimento, desde as fases pré-clínicas iniciais até a comercialização. Um processo de seleção de tecnologia com base científica é apresentado, com base em uma série de entradas, incluindo o perfil do produto alvo, propriedades do medicamento, extensas experiências de projetos anteriores, mapas de tecnologia e modelagem de absorção.
Introdução
Devido à crescente incidência de compostos com baixa solubilidade no pipeline de descoberta e desenvolvimento farmacêutico, o número de tecnologias capacitadoras que são empregadas para melhorar a absorção de drogas orais e a biodisponibilidade (BA) também está crescendo. As tecnologias comumente usadas nesta área foram extensivamente revisadas, 1 e incluem sais, cocristais, dispersões sólidas amorfas, nano e microcristais fabricados por redução do tamanho de partícula, complexação com ciclodextrina e tecnologias baseadas em lipídios.
Foi demonstrado que muitas dessas tecnologias aumentam o BA do fármaco, mas os produtos comerciais mais notáveis são aqueles que utilizam tecnologias baseadas em lipídios, dispersões sólidas amorfas e nanocristais: por exemplo, Neoral ® (ciclosporina, Abbott), uma cápsula cheia de líquido; Zepatier ® (grazoprevir e elbasvir, Merck) e Simpirica (sarolaner, Zoetis), dispersões sólidas amorfas produzidas por secagem por spray para a saúde humana e animal, respectivamente; Kaletra ® (lopinavir e ritonavir, Abbott), uma dispers de fmaco amorfo produzido por extrusão de fusão a quente (HME); e Emend ®(aprepitant, Merck), um comprimido contendo nanocristais. A precedência comercial dessas tecnologias capacitadoras essenciais apóia sua utilização contínua para abordar os estimados 40% a 70% dos candidatos a pipeline de desenvolvimento de Nova Entidade Química (NCE) que são considerados fracamente solúveis em água. As tecnologias de habilitação também são amplamente exploradas no caminho do produto 505 (b) (2) para reformular produtos existentes no mercado em produtos com melhor desempenho (por exemplo, "supergenéricos") ou durante a vida da patente do produto por meio de abordagens de gerenciamento de ciclo de vida. Os benefícios econômicos estão cada vez mais direcionando o interesse na via regulatória 505 (b) (2) e incluem um tempo mais rápido para o mercado, menores custos de desenvolvimento, evitando certos testes pré-clínicos e clínicos caros e repetitivos, e 3 a 5 anos de exclusividade de mercado, dependendo da extensão da mudança no medicamento aprovado anteriormente. Um exemplo de um produto 505 (b) (2) comercializado é o produto de cápsula dura contendo formulação lipídica Absorica ™ (Ranbaxy), que proporciona maior absorção de droga em jejum do que o Roaccutane originalProdutos ® / Accutane ® (Roche), oferecendo assim aos consumidores o potencial de se beneficiar do tratamento da acne independentemente das refeições 2 e concedendo à Ranbaxy os benefícios comerciais acima mencionados.
Devido à sua ampla aplicabilidade, de NCEs a medicamentos não patenteados, o campo da tecnologia habilitadora é inovador, dinâmico e altamente competitivo. De fato, a prevalência de medicamentos fracamente solúveis no pipeline de desenvolvimento é um foco principal para muitas organizações de pesquisa / desenvolvimento e manufatura de contrato (CRO / CDMO), apoiando o trabalho de desenvolvimento de medicamentos com uma ou mais abordagens de tecnologia de aprimoramento BA para avançar esses candidatos a medicamentos. Um número muito menor de empresas tem uma ampla gama de tecnologias e / ou a capacidade de apoiar esses esforços de tecnologia, desde o design e desenvolvimento até a produção em escala comercial. Este último ponto é particularmente importante, pois a necessidade de parceria com várias empresas durante um programa de desenvolvimento de medicamentos pode introduzir complexidade e risco no processo de desenvolvimento, resultando em atrasos significativos e custos adicionais na transferência de tecnologias e conhecimento. Isso pode ser crítico no ambiente de desenvolvimento de medicamentos de hoje, onde 70% a 80% dos novos medicamentos em investigação (INDs) são mantidos por pequenas empresas biofarmacêuticas que muitas vezes não têm os recursos internos para desenvolver e fabricar intermediários de medicamentos ou produtos farmacêuticos .3
Os que trabalham na área reconhecerão, é claro, vários fatos importantes.
- As diversas necessidades de todos os compostos farmacêuticos atualmente em desenvolvimento nas empresas farmacêuticas e dentro delas não podem ser atendidas por uma única tecnologia capacitadora.
- O sucesso do desenvolvimento é mais provável se uma tecnologia for apropriadamente combinada com as propriedades do composto e as necessidades do produto.
- Em muitos casos, mais de uma tecnologia pode ser utilizada com sucesso, e considerações comerciais como o formato de dosagem desejado (por exemplo, comprimidos versus cápsulas) podem desempenhar um papel decisivo.
Em outras palavras, os programas em que uma abordagem de tecnologia não se adapta melhor ao composto são mais propensos a vacilar em sua progressão devido a razões de viabilidade / estabilidade / escalabilidade ou devido ao fraco desempenho biofarmacêutico in vivo. Infelizmente, esta é uma ocorrência comum e destaca a necessidade clara de seleção de tecnologia apropriada para aumentar o nível de sucesso durante o desenvolvimento do medicamento, particularmente quando a absorção é baixa na ausência de uma tecnologia habilitadora. Embora muitas vezes procurada, a seleção de tecnologia eficaz pode permanecer elusiva, uma vez que depende de muitas entradas, não menos das quais é o acesso a tecnologias alternativas ou complementares e uma compreensão clara da ciência que rege os mecanismos de solubilização, absorção e destino metabólico de drogas.
O objetivo deste artigo é destacar os principais obstáculos físico-químicos e biológicos à exposição ao medicamento após a ingestão oral e, em seguida, descrever como um processo de seleção de tecnologia influencia essas propriedades básicas. Em seguida, discutiremos as ferramentas de seleção de tecnologia que foram desenvolvidas a partir de uma investigação profunda das principais tecnologias e do aproveitamento da experiência de centenas de projetos de aprimoramento BA.
Obstáculos físico-químicos para BA
Obstáculos físico-químicos ao fármaco BA oral incluem baixa solubilidade aquosa (uma propriedade termodinâmica e dependente da forma) e uma taxa lenta de dissolução (uma propriedade cinética). A baixa solubilidade da droga pode limitar a concentração máxima da droga que pode ser obtida no intestino delgado (o local primário para a absorção da droga) e, portanto, a absorção da droga, uma vez que é necessário um gradiente de alta concentração entre a droga no lúmen intestinal e a droga na parede intestinal para conduzir a difusão passiva para (através da camada de muco aquoso não mexido) e através da membrana intestinal. Uma taxa de dissolução lenta está quase sempre associada à baixa solubilidade do medicamento, mas é agravada nos casos em que a área de superfície do medicamento e / ou as taxas de difusão também são baixas. Uma taxa de dissolução lenta também pode limitar a absorção,
A baixa solubilidade do medicamento é uma propriedade comum aos medicamentos das Classes II e IV do Sistema de Classificação Biofarmacêutica (BCS). Fatores que sustentam a propriedade de baixa solubilidade são bem descritos 4 e incluem
- uma alta energia de rede cristalina, que geralmente aumenta com o aumento da temperatura de fusão ( Tm ) de um composto;
- uma baixa energia de solvatação aquosa, que geralmente diminui com o aumento do valor Log P de um composto (isto é, lipofilicidade) - freqüentemente referido como compostos “bola de graxa”; e
- uma combinação de ambos, em que o impacto de uma alta energia de cristal na solubilidade é exacerbado por uma baixa energia de solvatação - muitas vezes referida como compostos de "pó de tijolo".
Através de uma avaliação desses obstáculos, é possível racionalizar os principais meios pelos quais as tecnologias habilitadoras aumentam a solubilidade e a taxa de dissolução - ou seja, reduzindo a energia da rede do fármaco, aumentando a área de superfície do fármaco disponível ou aumentando a energia de solvatação. Por exemplo, lipídios, surfactantes e co-solventes aumentam o volume e o caráter das microfases hidrofóbicas dos fluidos GI, como vesículas e micelas. A maioria dos compostos de baixa solubilidade tem interações intermoleculares muito mais favoráveis com esses coloides hidrofóbicos, levando ao aumento da solubilização da droga nos fluidos GI.
Para elucidar esta distinção, a Figura 1 fornece uma separação simplificada de tecnologias de habilitação chave de acordo com os mecanismos primários de aumento da taxa de solubilidade / dissolução. Por exemplo, os nanocristais aumentam a taxa de dissolução aumentando a área de superfície disponível da droga e, potencialmente, aumentando a solubilidade da droga se as partículas tiverem diâmetro <100 nm e / ou mostrarem alguma mudança na estrutura cristalina, particularmente na superfície do cristal. As abordagens de secagem por pulverização e dispersão sólida de HME aumentam a solubilidade aparente do fármaco e, portanto, a taxa de dissolução isolando a forma amorfa de alta energia, mostrando obstáculos de estado sólido reduzidos à solubilidade, que é maximizada nos casos em que um fármaco é disperso em um material de matriz um nível molecular. 5 Por outro lado, as tecnologias baseadas em lipídios são eficazes no aumento da solubilidade do fármaco à medida que componentes lipídicos dispersos e digeridos se misturam com sais biliares endógenos e fosfolipídios para formar uma variedade de espécies coloidais. (ou seja, “semelhante se dissolve semelhante”). 6
Em muitos casos, no entanto, distinções claras não podem ser feitas porque algumas abordagens de tecnologia têm a capacidade de aumentar a solubilidade da droga por meio de efeitos de estado sólido e solvatação: por exemplo, sais e cocristais onde a introdução de um contra-íon ou conformador (respectivamente) pode alterar o energia de estado sólido (alterando o empacotamento molecular no cristal) e energia de solvatação (alterando a natureza do solvente local [por exemplo, pH no caso de um contra-íon de sal] ou alterando o fármaco para a forma ionizada) para aumentar a solubilidade . Além disso, as dispersões sólidas que utilizam materiais poliméricos anfifílicos, como acetato succinato de hidroxipropilmetilcelulose (HPMCAS) 7 ou surfactantes não iônicos 8também pode afetar a solvatação, enquanto a pré-dissolução de uma droga dentro de uma formulação à base de lipídios eliminará os obstáculos relacionados ao estado sólido para solubilidade e dissolução e, se formulado corretamente, manterá o composto em solução em todo o trato GI (embora, com uma alta proporção da droga solubilizada em um estado coloidal, em vez de na fase aquosa do fluido GI).
A Figura 1 é uma tentativa de combinar os obstáculos de solubilidade / dissolução do composto a uma respectiva tecnologia de formulação. Onde a baixa solubilidade origina-se principalmente de uma rede cristalina alta, a solubilidade se beneficiará mais de uma redução nas interações de estado sólido (por exemplo, dispersões sólidas), enquanto aqueles compostos que mostram afinidade limitada para solventes aquosos se beneficiariam mais de abordagens que enriquecem o ambiente GI com solubilizantes exógenos (por exemplo, formulações à base de lipídios). Esta diferenciação relativamente simples é simplesmente baseada nas propriedades físico-químicas do medicamento.
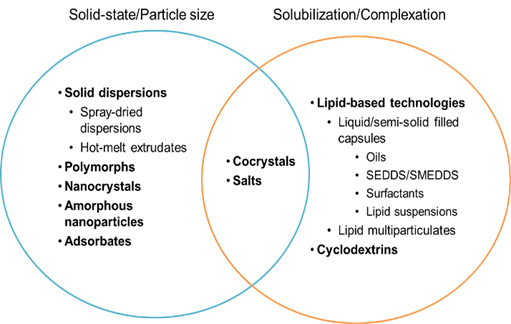
Obstáculos biológicos para BA
Em alguns casos, superar os obstáculos físico-químicos à baixa absorção pode não produzir o nível de BA desejado. Nestes casos, os obstáculos biológicos à exposição podem ser aparentes, os quais são conhecidos 9 e incluem
- efluxo da droga absorvida de volta para o lúmen intestinal (frequentemente P-gp ou mediado pelo transportador BCRP),
- metabolismo de drogas pré-sistêmico no intestino (principalmente via enzimas do citocromo P450), e
- extenso metabolismo hepático de drogas de primeira passagem.
Um bom exemplo que destaca a possibilidade de alcançar alta absorção de drogas, mas baixa BA, é a testosterona. Apesar de sua baixa solubilidade aquosa relativamente baixa (<25 µg / ml), a testosterona é bem absorvida pelo intestino, mas mostra BA extremamente baixa após extenso metabolismo de primeira passagem. 10 Assim, um extenso trabalho de formulação pode ser realizado para melhorar as propriedades físico-químicas do fármaco na tentativa de melhorar a absorção intestinal apenas para processos biológicos intrínsecos para tornar o fármaco ainda pouco biodisponível.
De maneira crítica, no contexto deste artigo, certas tecnologias capacitadoras podem ter a capacidade de atenuar esses obstáculos biológicos à AB, particularmente pela redução do efluxo e do metabolismo no intestino. De fato, ácidos graxos e surfactantes não iônicos (tipicamente, ésteres / éteres polietoxilados de óleos / ácidos graxos) comumente usados em tecnologias à base de lipídios têm frequentemente demonstrado inibir P-gp e transportadores de efluxo de BCRP em modelos de células intestinais 11 ou aumentar a permeabilidade transcelular, 12 com evidências de que esses efeitos também podem se manifestar in vivo , levando a maior exposição ao medicamento. 13Esses mesmos excipientes também estão cada vez mais implicados na inibição de uma variedade de enzimas do citocromo P450 que têm o potencial de metabolizar a droga na parede intestinal. 14,15
Além de eventos no enterócito, existe a possibilidade de que uma tecnologia de habilitação à base de lipídios possa, para drogas altamente lipofílicas, aumentar a fração de droga absorvida que entra no sistema linfático, onde as vias metabólicas hepáticas são evitadas. 16,17 Por exemplo, o éster undecanoato de testosterona exibe uma solubilidade aquosa muito mais baixa do que a forma nativa (<1 ng / ml versus ~ 25 µg / ml), mas demonstra maior BA oral devido a uma maior lipofilicidade e uma maior propensão para entrar no sistema circulação através do sistema linfático, particularmente quando formulado como uma solução lipídica 18(Andriol Testocaps®). De fato, foi demonstrado repetidamente que os excipientes lipídicos aumentam a BA de drogas altamente lipofílicas (ou seja, aquelas com valores Log D> 5 e solubilidade em triglicerídeos de cadeia longa> 50 mg / g) por meio do sistema linfático. 19
Certas tecnologias habilitadoras, particularmente as formulações à base de lipídios, têm, portanto, a capacidade de abordar os obstáculos físico-químicos e biológicos para alcançar uma exposição satisfatória ao medicamento. Isso destaca o valor de compreender quais fatores limitam a absorção do composto de interesse e selecionar imparcialmente uma tecnologia apropriada, particularmente quando os processos biológicos podem limitar o ganho geral na exposição usando tecnologias que afetam apenas a solubilidade e dissolução do medicamento.
Definindo as necessidades do produto
Além das propriedades físico-químicas e biofarmacêuticas de um composto, uma série de outras considerações normalmente afetam a seleção de tecnologia para uma aplicação particular, incluindo dose alvo, forma de dosagem final preferida e tamanho, frequência de administração, armazenamento específico e / ou requisitos de embalagem, aceitação de excipiente e potenciais direitos de propriedade intelectual (DPI). Em alguns casos, esses fatores desempenham um papel importante no processo de seleção de tecnologia. É, no entanto, importante observar que muitas, senão todas, essas "restrições de tecnologia" podem frequentemente ser identificadas antes que o trabalho de desenvolvimento seja iniciado, e tais considerações podem, portanto, ser valiosas, reduzindo o risco de buscar certas tecnologias que posteriormente são consideradas inadequado.
Seleção de tecnologia no aprimoramento BA
As soluções de forma de dosagem e entrega da Lonza oferecem recursos de desenvolvimento (GMP / não-GMP) em dispersões secas por pulverização amorfas (SDDs), extrudados de fusão a quente, nanocristais e cápsulas preenchidas com líquido / semissólido e multipartículas utilizando tecnologias baseadas em lipídios. Cada uma dessas tecnologias habilitadoras tem capacidade comprovada de aumentar a absorção de drogas e BA por meio de vários mecanismos diferentes, que foram profundamente investigados e formam a base de nosso processo de seleção de tecnologia e ferramentas. Coletivamente, a utilidade dessas respectivas tecnologias agora cobre um amplo espaço em termos de propriedades de medicamentos e desempenho alvo. Uma ampla gama de tecnologias e recursos complementares é crítica para o desenvolvimento ideal de medicamentos, permitindo imparcialidade e flexibilidade na seleção da plataforma de tecnologia ideal para um determinado composto.
O processo de seleção de tecnologia é governado por várias entradas (mostradas na Figura 2) para garantir que uma decisão informada seja feita para cada novo composto e perfil de produto alvo associado. Garantir que uma determinada tecnologia seja bem combinada com um composto de medicamento permite uma avaliação de viabilidade mais fácil, melhor desempenho in vivo de formulações de conceito inicial e sucesso final em alcançar o perfil de produto alvo.
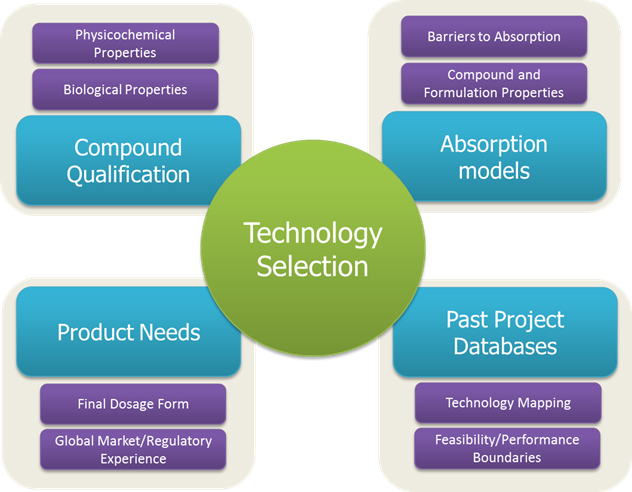
Como fica evidente na Figura 2, esse processo de seleção considera as necessidades gerais do produto. É necessário um diálogo robusto com os clientes para garantir que essas informações recebam atenção suficiente. Os aspectos que requerem consideração aqui incluem a dose alvo e as expectativas do cliente em relação ao tamanho, formato, aparência e embalagem da forma de dosagem final. Essas discussões são críticas para a seleção da tecnologia, bem como para o desenvolvimento pré-clínico e clínico inicial, uma vez que podem afetar elementos críticos para o sucesso final, como a conformidade. Na Lonza, essas discussões são amplamente apoiadas pela experiência no desenvolvimento de formulações na América do Norte, Europa e Ásia, onde pode haver uma variação significativa tanto nos requisitos regulamentares quanto nas preferências do paciente. A seleção da tecnologia também deve se basear em elementos específicos do composto na área de entrada da Qualificação do Composto da Figura 2 - ou seja, uma consideração de todas as propriedades físico-químicas e biológicas do medicamento que podem constituir obstáculos para o BA do medicamento e as propriedades que a experiência ensinou são essenciais para a viabilidade e aumento de escala de tecnologias robustas de SDD, HME, nanocristais e baseadas em lipídios. Mais uma vez, é essencial para a coleta dessas propriedades um diálogo eficaz e troca de informações e, se necessário, acesso a ferramentas in silico que podem ser usadas para prever como certas propriedades do composto (por exemplo, Log P e solubilidade) devem impactar desempenho, embora as medições experimentais sejam sempre preferidas. uma consideração de todas as propriedades físico-químicas e biológicas do medicamento que podem constituir obstáculos ao BA do medicamento e as propriedades que a experiência ensinou são essenciais para a viabilidade e aumento de escala de tecnologias robustas baseadas em SDD, HME, nanocristais e lipídios. Mais uma vez, é essencial para a coleta dessas propriedades um diálogo eficaz e troca de informações e, se necessário, acesso a ferramentas in silico que podem ser usadas para prever como certas propriedades do composto (por exemplo, Log P e solubilidade) devem impactar desempenho, embora as medições experimentais sejam sempre preferidas. uma consideração de todas as propriedades físico-químicas e biológicas do medicamento que podem constituir obstáculos ao BA do medicamento e as propriedades que a experiência ensinou são essenciais para a viabilidade e aumento de escala de tecnologias robustas baseadas em SDD, HME, nanocristais e lipídios. Mais uma vez, é essencial para a coleta dessas propriedades um diálogo eficaz e troca de informações e, se necessário, acesso a ferramentas in silico que podem ser usadas para prever como certas propriedades do composto (por exemplo, Log P e solubilidade) devem impactar desempenho, embora as medições experimentais sejam sempre preferidas.
A partir de uma compreensão fundamental das tecnologias capacitadoras e do trabalho de desenvolvimento anterior, duas dimensões adicionais foram introduzidas no processo de seleção de tecnologia: modelos farmacocinéticos preditivos baseados em fisiologia e mapas de tecnologia.
Em primeiro lugar, os modelos farmacocinéticos de base fisiológica (PBPK) são úteis para avaliar hipóteses sobre as barreiras à absorção, seja a taxa de dissolução, solubilidade e / ou permeabilidade. Um formulador pode usar modelagem de absorção para compreender os dados in vivo existentes para uma formulação de interesse ou estabelecer uma estrutura para prever o desempenho in vivo com os dados in vitro existentes . Esses modelos também podem ser úteis para prever atributos de formulação específicos de formulações habilitadas (por exemplo, dispersões sólidas amorfas, formulações à base de lipídios), como especiação de drogas e como espécies não dissolvidas - nanocolóides ou micelas de sal biliar - podem contribuir para a absorção. 20,21
Em nossa experiência, a melhor abordagem para usar a modelagem de absorção no desenvolvimento de formulações é por meio de testes de hipóteses e compreensão da sensibilidade dos parâmetros (ou seja, atributos críticos de biopermanência). Isso envolve a consideração cuidadosa de suposições (por exemplo, uma interpretação física pode ser fornecida para apoiar as suposições?), Dados in vitro incorporados ao modelo, bem como evitar "ajuste de curva" e realizar iterações para entender diferentes cenários in vivo que podem, em última instância, impactar desempenho de sua formulação.
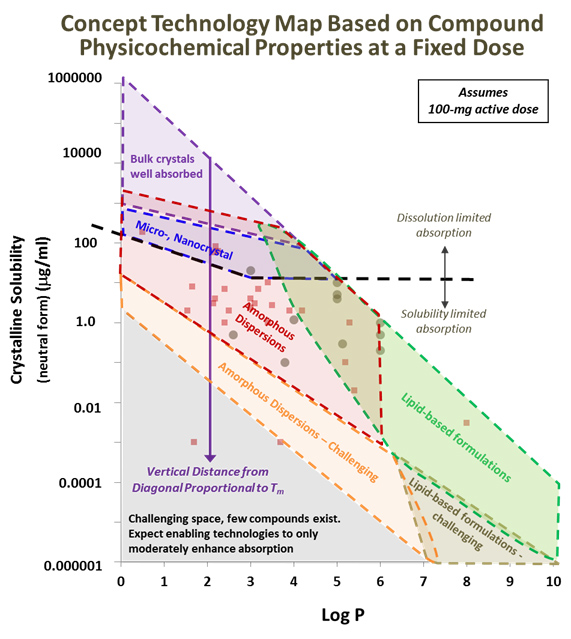
Em segundo lugar, após uma análise retrospectiva de nossos projetos de desenvolvimento anteriores, produzimos mapas conceituais de tecnologia centrados em como as principais propriedades físico-químicas dos medicamentos afetam a absorção oral. Esse esforço é auxiliado por nossa vasta experiência, como no desenvolvimento de formulações SDD, com mais de 5.000 compostos avaliados in vitro, mais de 1.500 compostos em estudos pré-clínicos e mais de 300 compostos em estudos clínicos. Um exemplo de mapa de tecnologia é ilustrado na Figura 3, em que os pontos de dados neste gráfico denotam alguns dos compostos que foram desenvolvidos com sucesso nos últimos anos. Neste gráfico, a solubilidade do composto em meio aquoso (forma cristalina de menor energia; sem micelas na mídia) é traçada em relação ao Log P. A linha diagonal sólida neste mapa traça a solubilidade máxima da forma neutra de energia mais baixa do composto, calculado por meio de uma equação de solubilidade geral modificada que assume que as interações de estado sólido do composto são desprezíveis (ou seja, o composto é um líquido à temperatura ambiente).m . Assim, em geral, quanto mais um composto cair abaixo da linha diagonal, maior será seu T m .
Na região superior deste mapa, a solubilidade cristalina é suficientemente alta para que a BA de uma dose de composto de 100 mg seja alta ao usar formulações simples e não habilitadoras. Com o aumento do Log P e / ou aumento da T m , no entanto, a diminuição da solubilidade cria a necessidade de tecnologias capacitadoras para manter uma boa qualidade in vivodesempenho. As tecnologias de redução do tamanho de partícula (por exemplo, micronização, nanocristais) podem oferecer BA aceitável em uma dose de 100 mg quando a solubilidade cai abaixo de 1 mg / ml, resultando na taxa de dissolução da droga não processada se tornando muito lenta para manter a concentração da droga em seu nível de equilíbrio enquanto está sendo absorvido. No entanto, conforme a solubilidade diminui ainda mais (ou seja, abaixo de 10 a 100 µg / ml, dependendo do Log P do composto), a utilidade de tais tecnologias irá tipicamente diminuir conforme a solubilidade atinge o ponto em que a absorção é inadequada, mesmo se houver alta dissolução taxas são alcançadas. Nessas baixas solubilidades, é necessário utilizar tecnologias que melhoram a concentração do fármaco no lúmen GI acima de sua solubilidade de equilíbrio e / ou transporte do fármaco através da camada de água não agitada por meio de coloides submicrônicos. As dispersões sólidas amorfas (incluindo SDDs e extrudados termofusíveis) são altamente eficazes em uma ampla faixa Log P (ou seja, Log P 0 a 6), mas no aumento da lipofilicidades do composto (ou seja,> Log P 6), excipientes adicionais fornecidos pelo lipídeo as tecnologias são frequentemente necessárias para solubilizar e melhorar o transporte do composto através da camada limite aquosa (também chamada de camada de água não agitada), que pode ser lenta e potencialmente limitar a absorção quando a droga é lipofílica. As tecnologias de lipídios são tipicamente aplicáveis quando Log P 5, então há alguma sobreposição para as abordagens amorfa e lipídica. Notavelmente, a utilidade ideal das tecnologias de lipídios na Figura 3 corresponde ao espaço abaixo da linha diagonal sólida (onde T mas ao aumentar a lipofilicidades do composto (isto é,> Log P 6), excipientes adicionais fornecidos por tecnologias de lipídios são frequentemente necessários para solubilizar e aumentar o transporte do composto através da camada limite aquosa (também chamada de camada de água não agitada), que pode ser lenta e potencialmente limitar a absorção quando a droga é lipofílica. As tecnologias de lipídios são tipicamente aplicáveis quando Log P 5, então há alguma sobreposição para as abordagens amorfa e lipídica. Notavelmente, a utilidade ideal das tecnologias de lipídios na Figura 3 corresponde ao espaço abaixo da linha diagonal sólida (onde T mas ao aumentar a lipofilicidades do composto (isto é,> Log P 6), excipientes adicionais fornecidos por tecnologias de lipídios são frequentemente necessários para solubilizar e aumentar o transporte do composto através da camada limite aquosa (também chamada de camada de água não agitada), que pode ser lenta e potencialmente limitar a absorção quando a droga é lipofílica. As tecnologias de lipídios são tipicamente aplicáveis quando Log P 5, então há alguma sobreposição para as abordagens amorfa e lipídica. Notavelmente, a utilidade ideal das tecnologias de lipídios na Figura 3 corresponde ao espaço abaixo da linha diagonal sólida (onde T que pode ser lenta e potencialmente limitar a absorção quando a droga é lipofílica. As tecnologias de lipídios são tipicamente aplicáveis quando Log P 5, então há alguma sobreposição para as abordagens amorfa e lipídica. Notavelmente, a utilidade ideal das tecnologias de lipídios na Figura 3 corresponde ao espaço abaixo da linha diagonal sólida (onde T que pode ser lenta e potencialmente limitar a absorção quando a droga é lipofílica. As tecnologias de lipídios são tipicamente aplicáveis quando Log P 5, então há alguma sobreposição para as abordagens amorfa e lipídica. Notavelmente, a utilidade ideal das tecnologias de lipídios na Figura 3 corresponde ao espaço abaixo da linha diagonal sólida (onde Tm está efetivamente à temperatura ambiente ou menos), refletindo o fato de que a solubilidade do composto em óleo diminuirá com o aumento da T m . Com efeito, as formulações de lípidos têm demonstrado utilidade no fornecimento de baixa T m compostos, mas o desenvolvimento de soluções lipídicas torna-se um desafio com alta T m compostos, a menos que a dose do composto por unidade de dosagem é baixo (isto é, <25 a 50 mg). Em outros casos (ou seja, onde os excipientes lipídicos ainda são necessários), as suspensões são uma opção viável para melhorar a BA. Da mesma forma para dispersões sólidas, uma alta T m pode ser limitante da viabilidade, por exemplo, exigindo o uso de temperaturas de processo mais elevadas em HME, o que por sua vez aumenta o risco de degradação do composto e / ou excipiente. Para SDDs, uma alta T mpode limitar a solubilidade em solventes de pulverização orgânicos comumente usados, resultando em um processo ineficiente com baixo rendimento. Para processar com eficiência tais compostos de alta T m , um processo de secagem por pulverização de alta temperatura (ou seja, o "processo de mudança de temperatura") foi desenvolvido, o que permite que uma suspensão de droga seja aquecida a altas temperaturas - muitas vezes bem acima do ambiente - ponto de ebulição da pressão do solvente - para dissolver o medicamento imediatamente antes de ser introduzido no secador por spray.
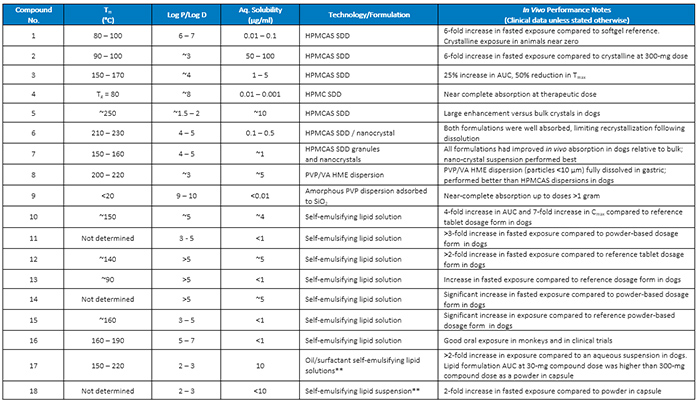
A Tabela 1 lista compostos específicos que exemplificam a relação entre as propriedades físico-químicas do fármaco e a capacidade de habilitação de tecnologias amorfas e baseadas em lipídios. Por exemplo, os Compostos 1 a 6 foram todos formulados com sucesso como SDDs amorfos e todos os seis forneceram a exposição direcionada quando dosados na clínica. Os valores de Log P para esses compostos variaram de cerca de 2 a cerca de 10, a solubilidade aquosa da forma cristalina neutra variou de menos de 0,01 μg / ml até ~ 100 μg / ml, e a Tm variou de ~ 80 ° C até cerca de 230 ° C. É claro a partir desta ampla gama de propriedades que a formulação como SDDs pode ser bem-sucedida para compostos com uma ampla gama de propriedades. O Composto 6 foi particularmente desafiador de formular devido à sua alta T me forte tendência para recristalizar a partir de estados amorfos ou de solução. Usando uma carga ativa baixa (10% w / w), SDDs foram desenvolvidos que estabilizaram a forma amorfa e tiveram um bom desempenho in vivo , mas dispersões nanocristalinas sólidas com cargas ativas mais altas foram desenvolvidas para este composto que teve um desempenho tão bom ou melhor do que o SDD . Os compostos 7 e 8 também tiveram uma forte tendência para cristalizar. No caso do Composto 7, as formulações nanocristalinas que não geraram soluções altamente supersaturadas após a dissolução tiveram o melhor desempenho in vivo . No caso do Composto 8, uma base solúvel em ácido, usando um polímero de dispersão não entérica, acetato de vinil de polivinilpirrolidona (PVP / VA) feito via HME promoveu a dissolução gástrica e embora tenha precipitado rapidamente em pH intestinalin vitro , no entanto, teve o melhor desempenho in vivo . Finalmente, o Composto 9, um líquido com alto Log P ( Tm <20 ° C) foi formulado como uma dispersão amorfa adsorvida a um transportador de dióxido de silício de alta área superficial. Esta formulação forneceu dissolução rápida do composto e, na clínica, resultou em absorção quase completa em doses até maiores do que 1 grama. Os compostos 10 a 18 na Tabela 1 representam projetos de desenvolvimento anteriores onde foi possível desenvolver formulações de lipídios para compostos que mostram uma ampla gama de valores de Log P (ou seja, entre 3 e 10, com comprovados in vivocapacidades para aumentar o BA em comparação com as formas de dosagem baseadas em drogas cristalinas. Os compostos 10 a 16 foram bons candidatos para a tecnologia de formulação de lipídios com base em suas respectivas propriedades físico-químicas e desempenho robusto (tanto in vitro quanto in vivo ); soluções lipídicas auto-emulsionantes foram desenvolvidas em cada caso. O composto 17 tinha obstáculos tanto físico-químicos (ou seja, baixa solubilidade) e biológicos (ou seja, efluxo de P-gp, metabolismo intestinal mediado por CYP P450) à exposição. Vários dois componentes (óleo / tensioactivo) auto-emulsionantes formulações que incorporam excipientes com capacidade de impacto estas barreiras biológicas foram subsequentemente concebidos, desenvolvidos, e mais tarde caracterizado por uma série de in vitrotestes, a partir dos quais as formulações de chumbo foram identificadas - ou seja, aquelas que efetivamente solubilizaram o composto quando a formulação foi dispersa e digerida em condições gástricas / intestinais simuladas. Em cães em jejum, as formulações de lipídios principais forneceram um aumento de 2 vezes na exposição em relação a uma suspensão aquosa e deram uma exposição mais elevada a uma dose de composto de 30 mg do que a de uma formulação de pó em cápsula a uma dose de composto de 300 mg .
Tabela 1 Propriedades físico-químicas selecionadas de 18 compostos anteriores em relação ao desempenho da formulação desenvolvida (** Esses compostos apresentaram barreiras biológicas comprovadas para BA, nomeadamente susceptibilidade ao efluxo de P-gp)
As propriedades físico-químicas do Composto 18 eram tais que não era possível dissolver completamente a dose alvo no veículo lipídico; no entanto, uma suspensão lipídica progrediu e, em um estudo clínico, apresentou melhor desempenho do que uma formulação de pó em cápsula devido, pelo menos em parte, à formulação que aborda algumas barreiras biológicas à absorção (por exemplo, efluxo, metabolismo).
Gráficos semelhantes aos da Figura 3 foram criados usando a relação T m ou T m / temperatura de transição vítrea (T g ) (para SDDs) versus Log P. Esses mapas de tecnologia auxiliam na seleção da tecnologia de habilitação apropriada quando o físico-químico as propriedades de um medicamento são o fator crítico que influencia a absorção oral.
Ao utilizar PBPK preditivo e mapeamento, os formuladores podem concentrar os experimentos iniciais na tecnologia mais provável de ser ideal - uma abordagem muito mais eficiente do que a triagem de formulação empírica paralela, uma vez que pode minimizar o uso de compostos e acelerar o desenvolvimento da formulação.
Perspectiva futura
Os modelos de absorção e mapas de tecnologia da Lonza são continuamente atualizados e refinados por meio de dados e experiência adquiridos por meio de um pipeline de projetos em constante expansão com NCEs e compostos existentes. Continuamos a investir em nosso entendimento fundamental e atualmente realizamos uma análise científica mais profunda de todos os nossos projetos de desenvolvimento para estabelecer melhores relações entre as propriedades dos medicamentos e o sucesso do desenvolvimento usando SDD, HME, nanocristais e tecnologias baseadas em lipídios.
Conclusões
As empresas legadas que compõem o Dosage Form and Delivery Solutions (DFDS) da Lonza estão na vanguarda do desenvolvimento de dispersão amorfa, nanocristal e formulação à base de lipídios, expandindo a aplicação e o alcance dessas tecnologias para superar as propriedades físico-químicas e biológicas dos medicamentos que impactar negativamente a BA.
O entendimento fundamental derivado desse investimento coletivo nas principais tecnologias facilitadoras facilitou os avanços na seleção de tecnologia baseada na ciência para o aprimoramento da BA, com claros benefícios na minimização da complexidade, tempo e custo do processo de desenvolvimento de medicamentos. Nosso processo de seleção de tecnologia foi resumido neste artigo e depende de uma série de entradas, que vão desde necessidades de produtos, propriedades de medicamentos, experiências de projetos anteriores, mapas de tecnologia e modelagem de absorção.
As vantagens dessa abordagem baseada na ciência foram discutidas e podem ser comparadas a casos em que um medicamento progride por um caminho de tecnologia específico, ou caminhos paralelos, onde as propriedades do medicamento e as necessidades do produto aumentam o alcance dessa tecnologia.
Também é importante observar que a abordagem Lonza DFDS para seleção de tecnologia depende de (1) propriedades do composto, que muitas vezes já estão disponíveis (ou de outra forma mensuráveis in silico); e (2) uma compreensão profunda das restrições de tecnologia em relação às necessidades do produto. Assim, nossa abordagem está em nítido contraste com abordagens mais empíricas que se concentram na “triagem” de várias tecnologias. Além de atrasar o desenvolvimento e exigir o que pode ser uma quantidade substancial de composto para avaliar efetivamente vários caminhos de tecnologia, o risco na triagem empírica é que um composto falhe em executar em todas as tecnologias (ou seja, o composto é considerado "não entregue"). Em muitos casos, no entanto, essa falta de sucesso pode resultar de uma falta de design / fabricação de formulação apropriada, ao invés da ineficácia da tecnologia fundamental.
Na Lonza DFDS, acreditamos que a melhor tecnologia capacitadora para um determinado medicamento pode muitas vezes ser prevista com base em uma compreensão detalhada das propriedades do composto, necessidades do produto e nossa extensa experiência anterior na distribuição de medicamentos. A compreensão científica das principais tecnologias de aprimoramento BA, propriedade intelectual e experiência em escala / fabricação foi integrada a uma oferta completa de design, desenvolvimento e fabricação comercial para clientes farmacêuticos que enfrentam desafios BA com compostos novos ou existentes. Essa capacidade e infraestrutura coletivas reduzem ainda mais o tempo de desenvolvimento, o risco e a complexidade, dando aos clientes farmacêuticos a opção de lidar com um único parceiro em todos os estágios do processo de desenvolvimento de medicamentos.
Agradecimentos
David Vodak, Hywel Williams, Hassan Benameur, Michael Morgen, Eduardo Jule, Dwayne Friesen e Aaron Stewart são reconhecidos por suas contribuições consideráveis para este white paper.
1 Williams, HD, NL Trevaskis, SA Charman, RM Shanker, WN Charman, CW Pouton e CJ Porter, “Strategies To Address Low Drug Solubility in Discovery and Development.” Pharmacol. Rev. , 65: 315-499 (2013).
2 Webster, GF, JJ Leyden e JA Gross, "Comparative Pharmacokinetic Profiles of a Novel Isotretinoin Formulation (Isotretinoin-Lidose) and the Innovator Isotretinoin Formulation: A Randomized, 4-Treatment, Crossover Study." J. Amer. Acad. Dermatol ., 69: 762-767 (2013).
3 Citeline e análise interna da Lonza (2019).
4 Grant, D. e T. Higuchi, Solubility Behavior of Organic Compounds. Wiley-Interscience, Nova York, 1990.
5 Leuner, C. e J. Dressman, “Improving Drug Solubility for Oral Delivery Using Solid Dispersions.” EUR. J. Pharm. Biopharm. , 50: 47-60 (2000).
6 Porter, CJH, NL Trevaskis e WN Charman, "Lipids and Lipid-Based Formulations: Optimizing the Oral Delivery of Lipophilic Drugs". Nature Rev. Drug Disc ., 6: 231-248 (2007).
7 Friesen, DT, R. Shanker, M. Crew, DT Smithey, W. Curatolo e J. Nightingale, "Hydroxypropyl Methylcellulose Acetate Succinate-Based Spray-Dried Dispersions: An Overview." Mol. Pharm. , 5: 1003-1019 (2008).
8 Sjökvist, E., C. Nyström, M. Aldén e N. Caram-Lelham, Physicochemical Aspects of Drug Release. XIV. Os efeitos de alguns surfactantes iônicos e não iônicos nas propriedades de uma droga moderadamente solúvel em dispersões sólidas. ” Int. J. Pharm. , 79: 123-133 (1992).
9 Wuand, C.-Y., e LZ Benet, "Predicting Drug Disposition Via Application Of BCS: Transport / Absorption / Elimination Interplay And Development Of A Biopharmaceutics Drug Disposition Classification System." Pharm. Res. , 22: 11-23 (2005).
10 Täuber, U., K. Schröder, B. Düsterberg, and H. Matthes, "Absolute Bioavailability of Testosterone After Oral Administration of Testosterone-Undecanoate And Testosterone." EUR. J. Drug Metab. Pharmacokinet. , 11: 145-149 (1986).
11 Yamagata, T., H. Kusuhara, M. Morishita, K. Takayama, H. Benameur e Y. Sugiyama. “Melhoria da absorção de drogas orais de topotecano por meio da inibição do transportador de efluxo xenobiótico intestinal, Proteína de resistência ao câncer de mama, por excipientes”, Drug Metab. Dispos ., 35: 1142-1148 (2007).
12 Aungst, BJ, "Absorption Enhancers: Applications and Advances", AAPS J. , 14: 10-18 (2012).
13 Martin-Facklam, M., J. Burhenne, R. Ding, R. Fricker, G. Mikus, I. Walter-Sack, e WE Haefeli, "Dose-Dependent Aument of Saquinavir Bioavailability by the Pharmaceutic Aid Cremophor EL." Br. J. Clin. Pharmacol. , 53: 576-581 (2002).
14 Christiansen, A., T. Backensfeld, K. Denner e W. Weitschies. Efeitos dos surfactantes não iônicos no metabolismo mediado pelo citocromo P450 in vitro ”. EUR. J. Pharm. Biopharm. , 78: 166-172 (2011).
15 Mountfield, RJ, S. Senepin, M. Schleimer, I. Walter e B. Bittner, "Potential Inhibitory Effects of Formulation Ingredients on Intestinal Cytochrome P450." Int. J. Pharm., 211: 89-92 (2000).
16 Noguchi, T., WNA Charman e VJ Stella, "The Effect of Drug Lipophilicity and Lipid Vehicles on the Lymphatic Absorption of Various Testosterone Esters." Int. J. Pharm. , 24: 173-184 (1985).
17 Shackleford, DM, WA Faassen, N. Houwing, H. Lass, GA Edwards, CJH Porter e WN Charman, "Contribution of Lymphatically Transported Testosterone Undecanoate to the Systemic Exposure of Testosterone after Oral Administration of Two Andriol Formulations in Conscious Linph Duct -Canulados. ” J. Pharmacol. Exp. Therapeut ., 306: 925-933 (2003).
18 Nieschlag, E., J. Mauss, A. Coert e P. Kićović, "Plasma Androgen Levels In Men After Oral Administration of Testosterone or Testosterone Undecanoate." Acta Endocrinol ., 79: 366-374 (1975)
19 Trevaskis, NL, WN Charman e CJH Porter. "Lipid-Based Delivery Systems and Intestinal Lymphatic Drug Transport: A Mechanistic Update." Adv. Drug Delivery Rev., 60: 702-716 (2008).
20 Stewart, AM, et al., "Impact Of Drug-Rich Colloids of Itraconazole and HPMCAS on Membrane Flux In vitro and Oral Bioavailability in Rats." Mol. Pharm ., 14 (7): 2437-2449 (2017).
21 Stewart, AM e ME Grass, "Practical Approach To Modeling the Impact of Amorphous Drug Nanoparticles on the Oral Absorption of Poorly Soluble Drugs." Mol. Pharm ., 17 (1): 180-189 (2020).
22 Friesen, DT, DD Newbold, JM Baumann, DB Dubose e DL Millard. Processo de secagem por pulverização, WO 2010 111132 A3
Nenhum comentário:
Postar um comentário