É hora de parar de usar a temperatura cinética média (MKT) no armazenamento e transporte de produtos farmacêuticos?
Por Tobias Kuners de Koenders , consultor administrativo, Tob Management

Percorremos um longo caminho no monitoramento e controle de condições em armazenamento e transporte de produtos farmacêuticos. Cinquenta anos após o artigo frequentemente citado de John D. Hayes, 1Estou propondo me afastar do conceito de MKT como a ferramenta para avaliar as variações de temperatura no transporte e armazenamento de medicamentos. O objetivo original do artigo de Hayes em 1971 era abordar as variações de temperatura baseadas no clima no armazenamento não controlado de produtos farmacêuticos para se relacionar a uma única temperatura que poderia ser substituída pelo teste de validade do produto. Explicado de forma diferente, MKT pode ser determinado calculando uma “temperatura virtual” que consideraria a variabilidade de temperatura esperada em uma determinada geografia. O artigo afirma claramente que, para aqueles produtos cuja constante de taxa de perda está relacionada à temperatura pela relação de Arrhenius, uma única temperatura virtual pode ser determinada na qual a taxa de perda é equivalente àquela desse padrão de mudança de temperatura.
No entanto, não foi até 2001 que J. Taylor da Medicine Controls Agency 2apresentou um aplicativo diferente para MKT. Isso foi rapidamente adotado pela indústria como uma ferramenta para avaliar o impacto das variações de temperatura na qualidade do medicamento e acabou sendo uma mudança marcante na aplicação do MKT, como ainda é usado até hoje. Órgãos reguladores propõem e usam como orientação para a indústria. Curiosamente, no artigo original de Taylor, é afirmado: “Condições estritas devem ser aplicadas ao uso de MKT. É aplicável apenas ao armazenamento de produtos sob condições de temperatura ambiente controlada (ou seja, aqueles rotulados como 'não armazene acima de 25C'). ” Além disso, no mesmo artigo, Taylor declara: “O MKT não deve ser usado para compensar o controle de temperatura deficiente das instalações de armazenamento.” Até o momento, o MKT continua a ser proposto nos capítulos USP <659> e <1079> e é apresentado como uma temperatura de armazenamento isotérmica que simula os efeitos não isotérmicos da variação da temperatura de armazenamento. No entanto, há pouca ou nenhuma ênfase na física ou química por trás do impacto das excursões de temperatura em medicamentos biológicos e outros medicamentos contemporâneos.
Neste artigo, proponho uma abordagem moderna às variações de temperatura no armazenamento e no transporte.
Armazenamento e transporte são funções de retenção, onde o primeiro é estacionário e o segundo é móvel. Em relação à exposição dos medicamentos à temperatura, não há justificativa para tratar o armazenamento de forma diferente do transporte. Em casos excepcionais, como vacinas que precisam ser armazenadas em temperaturas muito baixas (<-70 ° C), argumenta-se que o transporte a -20 ° C é aceitável, apenas porque o transporte a temperaturas abaixo de -70 ° C é complexo . No entanto, mesmo em temperaturas tão baixas, testes precisam ser feitos para comprovar a validade da declaração.
Limitações ao uso de MKT
A seguinte equação foi desenvolvida para uma “temperatura virtual” e a indústria usa essa equação para calcular o MKT.
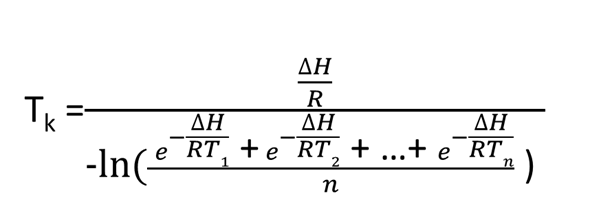

MKT é uma média não linear ponderada que mostra os efeitos das variações de temperatura ao longo do tempo. No entanto, sua aplicação só pode ser feita nos casos em que a estabilidade térmica do produto for conhecida e quando houver dados científicos disponíveis para apoiar tal afirmação.
Há muita base científica para o MKT; no entanto, envolve muitas suposições e dependências, por exemplo, MKT é considerada como temperatura de armazenamento isotérmica e é um conceito de uma função tempo / temperatura integrada. Para produtos cuja constante de taxa de perda está relacionada à temperatura pela relação de Arrhenius, uma única temperatura virtual pode ser determinada na qual a taxa de perda é equivalente àquela desse padrão de mudança de temperatura. Essas suposições e dependências, na maioria das vezes, nunca são demonstradas quando o MKT é utilizado para justificar as excursões de temperatura.
Em USP <659> 3, a definição de temperatura fria controlada (CCT) é: "A temperatura mantida termostaticamente entre 2 ° C [36 ° F] e 8 ° C [46 ° F] que permite uma excursão experimentada durante o armazenamento ou transporte … ”E a temperatura ambiente controlada (CRT) é definida como:“ A temperatura mantida termostaticamente… entre 20 ° C e 25 ° C [68 ° F a 77 ° F]. ”
No entanto, termostaticamente não é explicado com clareza. 3,4A maioria dos medicamentos embalados em embalagens primárias, como um frasco, um frasco, uma seringa ou um blister, também são embalados secundariamente em algum tipo de caixa, individualmente ou agrupados, para envio. Essas caixas normalmente são carregadas em série e, novamente, são embaladas em série em um remetente. Esses transportadores, empilhados em um palete e embalados com suportes de canto opcionais e embalagem extensível, estão prontos para o transporte. Imagine que, em tal composição, haja todos os tipos de bolsas de ar estacionárias, agindo como um tampão isolante para o medicamento embalado primário. Quando um palete é levado ao CRT ou CCT e condicionado por tempo suficiente para estar na temperatura exigida por completo, pequenos picos de temperatura na parte externa do palete, registrados pelo registrador de temperatura móvel, pode dar um perfil muito diferente em comparação com a temperatura dentro da embalagem primária. A posição do dispositivo de registro (registrador de temperatura) em relação ao medicamento é relevante para a excursão registrada, mas não necessariamente para a variação de temperatura observada do próprio medicamento.
Avanços na abordagem dos desafios de envio
O desenvolvimento de uma vacina ideal - de baixo custo, alta eficácia, estável ao calor e tolerante ao congelamento - não é tão fácil quanto pode parecer. Perfis de estabilidade 5,6 de proteínas / biológicos precisam ser compreendidos porque as enzimas ativadas por calor podem alterar dramaticamente a taxa de degradação em uma temperatura específica. A quebra de ligações covalentes também pode levar à degradação. Em temperatura abaixo de zero com proteínas em solução, pode ocorrer aglomeração. As proteínas são conhecidas por serem ativadas a uma temperatura corporal de 37 ° C, o que dá um claro limite superior. Os produtos liofilizados, por outro lado, quando expostos a temperaturas tão baixas quanto -20 ° C, não apresentam efeitos deletérios, permitindo exposições prolongadas a temperaturas bem abaixo de 0 ° C.
Muito tempo se passou desde 1971 e até 2001. Agora, olhando para o futuro, devemos considerar metodologias robustas e ferramentas inteligentes para evitar variações de temperatura em condições estacionárias e móveis. A indústria da construção fornece instalações de armazenamento sólidas com HVAC de tamanho apropriado para aquecimento, resfriamento e umidificação. A indústria de transporte provou caminhões com temperatura controlada passiva e ativa, contêineres e outros sistemas de contenção que podem lidar com transportes grandes e pequenos, remessas a granel e armazenamento, e até mesmo transporte e armazenamento de dose única se necessário, desde os primeiros quilômetros de o local de fabricação para os últimos quilômetros mais difíceis para o paciente. A indústria de embalagens tem muitos conceitos de embalagem estabelecidos para frascos, seringas e garrafas, para protegê-los contra a exposição externa de naturezas físicas. A flutuação da temperatura é uma das possibilidades óbvias, mas não ignore a exposição física, tanto contínua (vibração) quanto movimentos inesperados e repentinos (impacto de choque), radiação UV ou umidade. As variações de temperatura também podem afetar a integridade do fechamento e comprometer a esterilidade do produto em questão.
Em geral, durante o armazenamento, manuseio e transporte, um medicamento deve ser mantido nas condições de armazenamento recomendadas, em determinada faixa de temperatura de acordo com as instruções do rótulo, que garantam a manutenção de sua qualidade e, consequentemente, sua segurança e eficácia. Todas as medidas possíveis devem ser tomadas para evitar a exposição do produto a temperaturas inadequadas (muito altas ou muito baixas, pois o congelamento afeta adversamente os antígenos adsorvidos). O uso de registradores de temperatura ou monitores de frascos de vacina (VVM) pode detectar a exposição do medicamento a temperaturas fora das recomendadas.
O papel dos estudos de estabilidade
A estabilidade de um medicamento e, portanto, a vida útil, a data de validade e as condições de armazenamento propostas devem ser determinadas com base nos resultados de estudos de estabilidade em tempo real. Os estudos de estabilidade devem ser realizados em materiais representativos do processo de fabricação final e da formulação final.
A avaliação da estabilidade térmica de produtos farmacêuticos é uma tarefa difícil. Vários artigos científicos e livros abordam os desafios de avaliar a vida útil de produtos farmacêuticos. As investigações cinéticas do comportamento térmico de materiais para excursões de temperatura abaixo ou acima da faixa usada durante a coleta de dados são difíceis e complexas. Essa abordagem teórica e científica é boa em um ambiente acadêmico, mas não necessariamente uma representação prática do mundo real.
Durante o ciclo de vida do medicamento - desde quando sai da fabricação e é armazenado pela primeira vez, até o armazenamento móvel, quando pode ser movido para uma localização central ou satélite e depois para uma sequência de pontos de distribuição ou depósitos, até o ponto onde é entregue na farmácia ou hospital e daí para o paciente - as condições podem ser monitoradas e registradas e as amostras coletadas para confirmar a segurança e eficácia.
Os dados gerados em estudos de estabilidade acelerada podem ser usados, além dos dados de estabilidade em tempo real, para apoiar as especificações de liberação mínima propostas, quando o produto final está sujeito a variações de temperatura durante o manuseio e transporte.
Os estudos de estabilidade em produtos embalados comercialmente devem apoiar as exposições planejadas de medicamentos a temperaturas associadas a variações de temperatura esperadas, bem como a temperatura de armazenamento rotulada. Esses estudos incluem condições para rotulagem, embalagem e inspeção, bem como envio de medicamentos para distribuidores comerciais. A condução de estudos de estabilidade acelerados e de longo prazo em paralelo, em vez de consecutivamente, economiza tempo.
Os estudos de prazo de validade são comuns para medicamentos. Os testes de ciclo de temperatura e, em menor extensão, os estudos de congelamento-descongelamento, devem ser considerados antecipadamente como parte do programa de estudo de estabilidade para poder abordar a excursão da temperatura de forma factual, em vez de acadêmica.
Conclusão
Em 1971, armazéns, veículos com temperatura controlada, embalagens ativas e passivas e dispositivos de medição e registro não foram desenvolvidos para os padrões de hoje. Ainda pode haver razões para pensar que o MKT é uma fuga aceitável para justificar excursões fora dos limites de estabilidade inicial abrangente, embalagem e resultados do estudo de qualificação de transporte 7 . No entanto, o motivo mais comum para a aposentadoria da MKT é o fato de termos evoluído 50 anos. Desde a primeira introdução do MKT, armazéns, veículos com temperatura controlada, embalagem ativa e passiva, medição e dispositivos de registro amadureceram, foram amplamente aprimorados e podem ser usados em tempo real, a qualquer hora, em qualquer lugar.
Hoje, não há limitações técnicas ou barreiras para saber tudo sobre uma instalação de remessa ou armazenamento em qualquer lugar da face da Terra, em qualquer época do ano. Desenhar, planejar, executar e relatar tais estudos não é uma tarefa simples, mas isso não deve nos fazer recuar. A segurança e a eficácia dos medicamentos, vacinas e terapias contemporâneas dependem disso.
Referências:
- Journal of Pharmaceutical Sciences - J.Pharm. Sci. Volume 60, edição 6, páginas 927-929 (01 de junho de 1971) - John D. Hayes, - Worldwide Virtual Temperatures for Product Stability Testing
- The Pharmaceutical Journal, 28 de julho de 2001, Volume 267, páginas 128-131 - J. Taylor, Recomendações sobre o controle e monitoramento das temperaturas de armazenamento e transporte de medicamentos.
- Farmacopeia dos Estados Unidos USP <659> Requisitos de embalagem e armazenamento, compêndio da USP! monografias
- Farmacopeia dos Estados Unidos USP <1079> Boas práticas de armazenamento e distribuição de medicamentos, compêndios da USP! monografias
- OMS / BS / 06.2049 - Diretrizes finais da Organização Mundial da Saúde para avaliação da estabilidade de vacinas.
- Guia para controle e monitoramento de condições de temperatura de armazenamento e transporte para medicamentos e substâncias ativas, Autoridade reguladora de produtos de saúde HPRA, IA-G011-2 (17 de junho de 2017)
- https://www.pharmaceuticalonline.com/doc/pharmaceutical-transport-validation-where-to-begin-0001
Sobre o autor:
 Tobias Kuners, da Koenders, é consultor administrativo da Tob Management, uma empresa de consultoria baseada na Holanda que fornece expertise técnica e de negócios para as indústrias farmacêutica, biotecnológica, de dispositivos médicos e FSMP (alimentos para fins médicos especiais). Ele trabalhou na Biogen, Ipsen, Thermo Fisher, Kite Pharma e Danone, entre outras empresas, ganhando experiência prática em serviços de engenharia, qualificação de equipamentos, manutenção, cadeia de suprimentos, armazenamento e distribuição. Ele liderou o projeto, a engenharia e a construção de várias instalações para atender aos requisitos do cGMP. Ele realiza auditorias, identifica lacunas e desenvolve planos de remediação, trabalhando dentro das organizações para auxiliar nas investigações de desvios e na implementação do CAPA e para desenvolver soluções científicas baseadas em risco. Você pode contatá-lo emtobias.kunersofkoenders@tobmanagement.nl
Tobias Kuners, da Koenders, é consultor administrativo da Tob Management, uma empresa de consultoria baseada na Holanda que fornece expertise técnica e de negócios para as indústrias farmacêutica, biotecnológica, de dispositivos médicos e FSMP (alimentos para fins médicos especiais). Ele trabalhou na Biogen, Ipsen, Thermo Fisher, Kite Pharma e Danone, entre outras empresas, ganhando experiência prática em serviços de engenharia, qualificação de equipamentos, manutenção, cadeia de suprimentos, armazenamento e distribuição. Ele liderou o projeto, a engenharia e a construção de várias instalações para atender aos requisitos do cGMP. Ele realiza auditorias, identifica lacunas e desenvolve planos de remediação, trabalhando dentro das organizações para auxiliar nas investigações de desvios e na implementação do CAPA e para desenvolver soluções científicas baseadas em risco. Você pode contatá-lo emtobias.kunersofkoenders@tobmanagement.nl
Nenhum comentário:
Postar um comentário