Chaves para um lançamento comercial rápido de sucesso

INTRODUÇÃO
As empresas farmacêuticas e de biotecnologia estão gastando anos e milhões de dólares desenvolvendo medicamentos ou prometendo novos produtos biológicos, tudo com a esperança de salvar ou melhorar a vida dos pacientes. Em alguns casos, é uma “corrida até o fim” e, quanto mais rápido uma empresa conseguir levar seu produto aos pacientes, melhor.
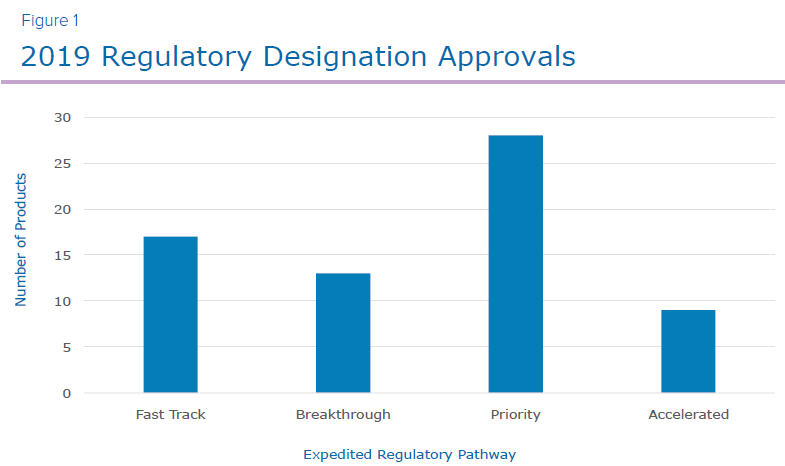
O FDA aprovou 48 novos medicamentos em 2019, o terceiro maior número de aprovações em mais de duas décadas. Dos produtos aprovados, 17 foram designados como via rápida, 13 eram terapias inovadoras, 28 eram revisão prioritária e outros 9 receberam aprovação acelerada (Figura 1). Sessenta por cento das 48 aprovações de novos medicamentos foram designadas em uma ou mais das quatro categorias aceleradas. Com novos medicamentos adicionais planejados para aprovação nos próximos anos, juntamente com modalidades novas e emergentes, é imperativo que as empresas invistam tempo e recursos adequados no planejamento estratégico e atividades de preparação para garantir as melhores chances de um lançamento comercial bem-sucedido.
“Garantir que a empresa patrocinadora e o parceiro de fabricação estejam alinhados é absolutamente a chave para o sucesso do lançamento de um produto. A Catalent, tendo atingido quase 50% das aprovações do FDA nos últimos 10 anos, tem experiência para levar produtos biológicos, pequenas moléculas, vacinas e muito mais ao mercado para patrocinadores de medicamentos ”, disse Jason Spacek, vice-presidente de operações comerciais da América do Norte Catalent Biologics.
COMO PLANEJAR UM LANÇAMENTO TRADICIONAL A seguir estão as principais considerações que o cliente e o parceiro de lançamento devem considerar durante a fase de planejamento do lançamento comercial:
A seguir estão as principais considerações que o cliente e o parceiro de lançamento devem considerar durante a fase de planejamento do lançamento comercial:
- Concordar com o cronograma: o cliente e o parceiro de lançamento precisam concordar com um cronograma, incluindo a aprovação da arte.
- Entenda as principais entradas e relacionamentos: Identifique as principais partes interessadas para auxiliar no gerenciamento do fluxo de informações e na comunicação entre os grupos para identificar e mitigar riscos.
- Identificar riscos e criar planos de mitigação: A identificação de riscos pode incluir o processo de aprovação para documentação subsequente, trabalho de validação necessário e produção subsequente e liberações de qualidade. Planos de mitigação devem ser criados para antecipar cenários nos quais os requisitos não são atendidos de acordo com o cronograma.
- Forneça atualizações diárias: atualizações diárias para a equipe do projeto e a equipe do cliente são essenciais para o planejamento do sucesso de um lançamento. Ele garante a cooperação e a comunicação entre os parceiros e ajuda a identificar os riscos e garantir que os planos de mitigação estejam em vigor.
- Pratique a comunicação aberta: a comunicação aberta e precisa entre os parceiros é a chave para o sucesso de qualquer lançamento comercial. Você precisa ter discussões abertas e diretas sobre o plano do projeto para seguir em frente e ficar à frente do cronograma acordado.
- Entenda as funções: é importante entender quais contrapartes seniores em ambas as organizações precisam ser avaliadas, de forma que, se os problemas precisarem ser escalados, alguém do patrocinador e do fabricante esteja em posição de ajudar.
Denis Johnson, vice-presidente e gerente geral das instalações da Catalent Biologics em Bloomington, Indiana, vê a empresa formando parcerias estratégicas para ajudar os produtos farmacêuticos e de biotecnologia a lançar produtos no mercado com mais rapidez. “Muitas vezes, um lançamento tradicional pode não ser o melhor para o paciente. Se um medicamento é o primeiro de seu tipo para uma doença com risco de vida, a Catalent pode trabalhar com seus parceiros para acelerar esse processo por meio do que chamamos de lançamento rápido ”, diz Johnson.
O QUE É UM LANÇAMENTO RÁPIDO?
Combinar um lançamento rápido após a aprovação regulatória com mensagens eficazes e serviços pós-lançamento é a chave para tornar seu lançamento bem-sucedido e obter uma vantagem competitiva. Um lançamento rápido permite que o patrocinador e o parceiro de fabricação trabalhem juntos para fornecer medicamentos aos pacientes o mais rápido possível após a aprovação regulatória.
A Catalent Biologics tem sido líder da indústria em impulsionar o rápido lançamento de produtos para uma variedade de clientes na última década, fornecendo uma entrega rápida ao mercado, o que é imperativo em alguns casos para os pacientes.

ESTUDOS DE CASO DE LANÇAMENTO RÁPIDO
Vamos dar uma olhada em exemplos do mundo real de lançamentos rápidos possibilitados pela experiência da Catalent e pela parceria com empresas patrocinadoras.
Estudo de caso 1: Lançamento de produto para um novo mercado em 30 dias A
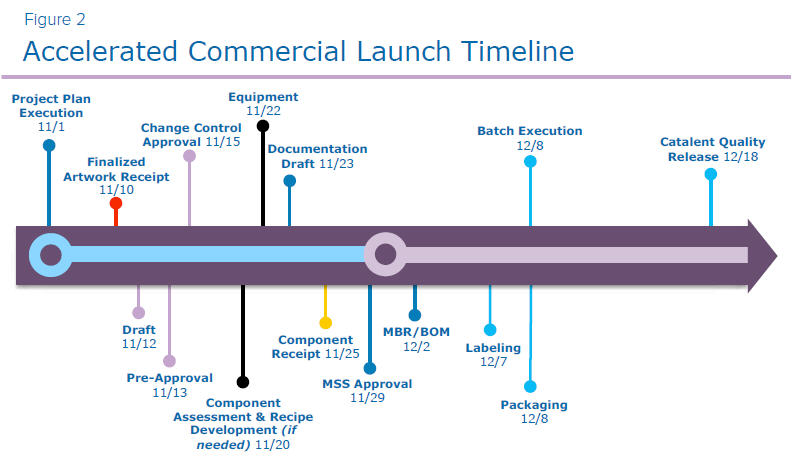
Catalent trabalhou com um patrocinador de medicamento que queria que seu produto biológico chegasse ao mercado em 30 dias após a aprovação regulatória - não é uma abordagem típica para um lançamento rápido, exigindo comunicação e colaboração extremamente próximas. Eles exigiam um lançamento de produto subsequente de um único produto com dois SKUs e oito componentes.
 O lançamento do projeto começou no ponto em que o material a granel já havia sido envasado na unidade. Veja a Figura 2 para cronograma.
O lançamento do projeto começou no ponto em que o material a granel já havia sido envasado na unidade. Veja a Figura 2 para cronograma.
- O verdadeiro início do cronograma para a equipe do projeto foi o recebimento da arte finalizada . Este é o desenho da arte aprovado pela região onde o produto foi lançado.
- As próximas etapas envolveram uma série de processos de aprovação , incluindo a aprovação do rascunho da arte, a pré-aprovação e a aprovação final entre a Catalent, o fornecedor de impressão e a empresa patrocinadora.
- A Catalent requer um controle de alterações para documentar o lançamento inicial no mercado. Com a aprovação do patrocinador, também podemos precisar atualizar a arte para refletir uma determinada necessidade ou exigência naquele mercado.
- Se necessário, passamos para a preparação de validação . Devido a diferentes aspectos de componentes ou desenvolvimento de receita, vários tipos de validação do trabalho de engenharia podem ser necessários para garantir a fabricação precisa no dia da produção. Se necessário, um protocolo de equipamento é elaborado e executado, juntamente com um relatório resumido de qualificação de processo (PQ), finalizado antes do registro do lote. No entanto, este projeto não exigiu preparação para validação.
- A próxima etapa foi a documentação e a ordem de execução do lote, incluindo Master Batch Records (MBR), folha de especificação de material e mestre de itens. Esses itens foram agrupados e movidos pelo processo de revisão e aprovação, com a aprovação da Catalent e do patrocinador.
- Em seguida, a Catalent trabalhou ativamente com fornecedores de impressão para garantir um retorno rápido na entrega da impressão. Na maioria dos casos, temos um tempo de resposta garantido de 15 dias, desde o recebimento da arte finalizada até a finalização da entrega à Catalent.
- Após o recebimento do componente, os materiais de impressão eram movidos para o controle de qualidade de entrada da Catalent para inspeção e liberação para manufatura posterior. Após o lançamento, o produto passou por rotulagem e embalagem conforme orientação do MBR aprovado.
- A etapa final inclui a liberação de qualidade do site da Catalent para o cliente. Devido ao cronograma de execução, normalmente trabalhamos por meio de uma liberação acelerada, mitigando desvios à medida que avançamos no processo de fabricação para garantir um retorno rápido na liberação de qualidade.
- Assim que a liberação de qualidade da Catalent foi concluída, os registros do lote foram carregados em um site comum do SharePoint®, com a empresa patrocinadora completando sua revisão de qualidade e liberação desses registros antes de enviar o lote para o próximo nó de fornecimento (normalmente o centro de distribuição regional).
Estudo de caso 2: Lançamento rápido 24 horas A Catalent tinha um relacionamento estratégico com um patrocinador que pretendia lançar um produto 24 horas após a aprovação do FDA. Esta foi uma abordagem de lançamento rápido altamente incomum, exigindo que ambos os parceiros fossem extremamente diligentes em suas comunicações e planos de execução, o que lhes permitiu trabalhar juntos para concluir o primeiro de vários lançamentos rápidos da Catalent.
Catalent tinha um relacionamento estratégico com um patrocinador que pretendia lançar um produto 24 horas após a aprovação do FDA. Esta foi uma abordagem de lançamento rápido altamente incomum, exigindo que ambos os parceiros fossem extremamente diligentes em suas comunicações e planos de execução, o que lhes permitiu trabalhar juntos para concluir o primeiro de vários lançamentos rápidos da Catalent.
As seguintes etapas foram realizadas para realizar o lançamento rápido de 24 horas:
- A Catalent iniciou imediatamente o processo de planejamento com uma série de exercícios de planejamento de cenários de risco , usando essas ferramentas para esclarecer com o patrocinador como seria um lançamento bem-sucedido das perspectivas de custo, prazo e tolerância ao risco.
- A equipe do projeto passou para uma série de fluxos de processo detalhados , identificando as atividades que precisavam acontecer para tornar a linha do tempo uma realidade e quem seria o responsável pela execução de cada atividade.
- A equipe observou quais pessoas ou grupos eram responsáveis por empurrar ou puxar informações pela instalação, ao mesmo tempo em que identificava cada grupo que interagiria com o produto.
- Durante o planejamento e execução, a equipe da Catalent reuniu e agiu com base em feedback útil das partes interessadas envolvidas. Foram estabelecidos canais de comunicação claros para que, caso houvesse uma preocupação, houvesse clareza sobre onde e como obter respostas precisas e oportunas.
- Antes do lançamento real do produto, atualizações detalhadas e resumos eram fornecidos para a equipe multifuncional e outras partes interessadas diariamente . Essa prática ajudou a garantir pontos de contato frequentes e comunicação sobre o status do projeto.
DESAFIOS CONHECIDOS NOS LANÇAMENTOS RÁPIDOS
Os lançamentos comerciais rápidos sempre trazem desafios. Aqui, damos uma olhada em alguns dos desafios e principais lições ao lidar com possíveis obstáculos que podem surgir durante o processo.
- Atrasos na aprovação de arte
- Alinhamento de Especificação
- Requisitos de validação (se necessário)
- Falha de componente
- Execução (planejamento, usinabilidade, recursos)
- Desvios (Prevenção de Liberação em Lote)
Atrasos na aprovação de obras de arte são um desafio comum durante os lançamentos rápidos. Cada agência reguladora tem seus próprios prazos contra os quais trabalha ao obter a aprovação do trabalho artístico. Assim que a revisão da arte regulatória for concluída, a agência reguladora pode atrasar a liberação dessa aprovação. A aprovação da arte pode levar de 24 horas a várias semanas. É importante calcular esse risco em seu plano de mitigação de lançamento.
Outro desafio que pode surgir é o alinhamento das especificações. As especificações devem ser verificadas pelo parceiro de lançamento antes do encaminhamento para aprovação. Se as especificações não forem alinhadas ou alteradas durante o processo de revisão da agência, a arte deve ser devolvida para ser reescrita e reaprovada, causando mais atrasos.
Os requisitos de validação também podem afetar a data de lançamento se forem exigidos e não forem detectados na revisão da arte. Isso pode incluir uma mudança no tamanho do componente, uma mudança na impressão de um componente ou requisitos de validação conhecidos, como uma mudança na serialização.
Para mitigar a possibilidade de falhas de componentes, o patrocinador do medicamento deve se concentrar no fornecedor de impressão que fornece rótulos, bulas e embalagens nas quais o produto será embalado. Quando esses componentes passam pela inspeção de entrada, existe o risco de falha. Essas falhas normalmente exigem uma revisão da equipe de qualidade para determinar se essa falha específica do produto atrasará um componente de chegar ao mercado.
Todos esses desafios estão relacionados à execução do cronograma de lançamento. Qualquer falha de componente ou requisito de validação pode atrasar a data de produção planejada. A usinabilidade ou os recursos também podem ser outro desafio que pode ser mitigado para garantir a execução dentro do prazo.
Por último, desvios , que são itens que exigem investigação ou documentação adicional antes da liberação do lote, podem colocar a data de liberação em risco.
CHAVE PARA O SUCESSO
 Desafio 1: Complexidade - o lançamento do produto é um processo de várias etapas e altamente regulamentado; as equipes são compostas por colaboradores internos e externos de processo com conhecimento, com uma urgência para a transferência de informações, apresentando um desafio para cumprir os marcos planejados.
Desafio 1: Complexidade - o lançamento do produto é um processo de várias etapas e altamente regulamentado; as equipes são compostas por colaboradores internos e externos de processo com conhecimento, com uma urgência para a transferência de informações, apresentando um desafio para cumprir os marcos planejados.
Chaves para o Sucesso : Planejamento e Gerenciamento de Riscos - Inclui articular a declaração do problema, entender como são bons resultados, praticar com um propósito, estabelecer uma base para medir o progresso e investir no planejamento de cenário apropriado.
Desafio 2: Compreensão cultural de urgência - Este desafio pode incluir complacência com o status quo, tempo de resposta, lidar com informações, cenários push versus pull e fechar a lacuna entre a execução e o planejamento.
Chaves para o sucesso : mecanismos de comunicação e operação - Pratique a comunicação excessiva, participe de discussões iniciais face a face, comemore vitórias graduais e projete um mecanismo de relações públicas de maneira eficaz.
Desafio 3: Processo de escalonamento - Uma pressão intensa para entregar sucesso, distância da execução do processo e um baixo nível de controle aumentam os desafios.
Chaves para o Sucesso : Governança e Liderança - Utilizando canais de escalonamento com eficácia, aproveitando a estrutura de liderança de cada organização conforme necessário e gerando relatórios de projeto concisos, fáceis de entender e frequentes.
SOBRE CATALENT BIOLOGICS
Por mais de duas décadas, a Catalent Biologics construiu capacidades e experiência em desenvolvimento, fabricação e serviços analíticos para novas entidades biológicas, terapias gênicas, biossimilares e conjugados anticorpo-droga. A empresa trabalhou com 600+ mAbs e 80+ proteínas, e mais de 120 testes clínicos ativos e 13 produtos comercializados usaram a tecnologia de engenharia de linha celular GPEx®. Outros 35+ produtos comercialmente aprovados empregaram os recursos da Catalent Biologics até o preenchimento / acabamento do medicamento.
Catalent Cell & Gene Therapy, uma unidade da Catalent Biologics, é um parceiro de serviço completo para vetores de vírus adeno-associados (AAV) e imunoterapias CAR-T, com profunda experiência em aumento de escala e produção de vetores virais. A Catalent adquiriu recentemente a MaSTherCell, agregando experiência no desenvolvimento e fabricação de terapia celular autóloga e alogênica. A Catalent produziu mais de 100 lotes de cGMP em mais de 70 programas clínicos e comerciais.
Usando tecnologia avançada e soluções personalizadas para clínicas por meio de fornecimento comercial, a Catalent Biologics oferece melhores tratamentos biológicos aos pacientes, com mais rapidez.
Nenhum comentário:
Postar um comentário