Escolha de uma formulação e abordagem de processo para produtos de liberação controlada oral

Você quer desenvolver um produto de liberação controlada oral (OCR)? Nesse caso, você perceberá rapidamente que há muitas perguntas a serem respondidas. O que você deseja que a forma de dosagem final faça? Que formulação e abordagem de processo você vai usar? Que armadilhas e obstáculos você pode encontrar? Compreender as opções e suas ramificações é o primeiro passo para elaborar um plano.
Introdução
Escolher a abordagem errada para desenvolver e fabricar seu produto de liberação estendida (ER) pode deixá-lo em um beco sem saída. Sem um caminho a seguir, você terá dinheiro e tempo para recomeçar? Ou seu produto simplesmente ficará no esquecimento?
Este white paper sozinho não pode resolver esse problema complexo. O que ele pode fazer é oferecer algumas considerações, uma estrutura e algumas perguntas de orientação para ajudá-lo a tomar decisões informadas enquanto trabalha para encontrar uma solução.
Em 1952, a primeira aprovação do mercado dos Estados Unidos para um produto farmacêutico de liberação controlada foi concedida à Smith, Kline & French para seu Dexedrine Spansule. Desde então, muitas abordagens variadas e bem-sucedidas para a criação de medicamentos OCR foram desenvolvidas. Hoje, mais de 65 anos depois, uma variedade surpreendentemente ampla de formulações de liberação controlada é possível. No entanto, desenvolvê-los pode exigir mais tempo, recursos e esforço do que o esperado. Contar com a ajuda de um formulador de OCR experiente pode acelerar o processo e garantir o sucesso do seu projeto, especialmente para formulações complicadas que requerem vários ingredientes farmacêuticos ativos (APIs) ou padrões de liberação complexos.
Escolher a melhor tecnologia e abordagem para seu produto pode evitar muita frustração e custos no caminho para a aprovação.
Aprendendo com dois produtos que falharam
O que acontece se você escolher o caminho errado para o seu produto?
Imagine que sua empresa fabrique um comprimido ER com cinco dosagens. O produto está na longa cauda de declínio - tornou-se genérico - mas ainda está ganhando milhões de dólares e é importante para sua pequena empresa. O site original de fabricação está fechando e o produto deve ser transferido. Aqui está o problema: as cinco dosagens não são proporcionais à dose, o que significa que você não pode se qualificar para um bioispensador. Se você transferir a produção, terá que realizar avaliações de bioequivalência separadas para cada dosagem. Você também terá que conduzir estudos de estabilidade separadamente para que não haja chance de reduzir o esforço por meio de colchetes. Todas essas avaliações são caras, e se alguns pontos fortes passarem e outros falharem, você '
Agora imagine um produto diferente: uma cápsula ER multiparticulada no desenvolvimento da Fase II. Existem cinco camadas de revestimento nos grânulos: um revestimento de vedação no substrato, a primeira camada de medicamento, outro revestimento de vedação, a camada de polímero ER e um revestimento externo de medicamento de liberação imediata. Seu desenvolvedor usou equipamento incomum para desenvolver o produto. O processo e a formulação são robustos e eficientes e atingem exatamente o perfil clínico desejado. Então qual é o problema? Seu parceiro de desenvolvimento não faz manufatura comercial. Agora você precisa encontrar um local de fabricação comercial com a experiência, o equipamento, a capacidade e o interesse exatos para assumir sua produção.
A viabilidade é importante para o desenvolvimento, escalabilidade e transferência
Os produtos podem apresentar problemas de várias maneiras. O produto pode ser muito caro para ser fabricado em relação aos produtos concorrentes. O tempo necessário para a fabricação pode ser muito longo e caro em relação à concorrência. A abordagem pode ser tecnicamente inadequada para a funcionalidade desejada. Os pacientes podem não gostar do produto ou ser incapazes de tomá-lo. O plano de manufatura original pode falhar com poucas opções de manufatura de backup. A escala de produção pode não acompanhar a demanda.
No mínimo, remediar problemas como esses custa tempo e dinheiro que você não vai querer gastar. Na pior das hipóteses, as soluções são econômica ou tecnicamente inviáveis e o produto nunca vê a luz do dia.
A viabilidade de desenvolvimento é uma das maiores preocupações para desenvolvedores de produtos farmacêuticos que consideram um projeto de OCR. Menos óbvio é que a expansão, redução e viabilidade de transferência também devem ser consideradas nesta fase. Para fazer as escolhas certas para produzir uma formulação viável, não apenas para aprovação, mas para toda a vida útil do produto, é fundamental compreender as opções de design e formulação.
Tomar decisões informadas desde o início economizará tempo, dinheiro e frustração. A complexidade do produto proposto, a estratégia clínica provável e o grau de competição de mercado que o cerca devem ser levados em consideração no plano.
Antecedentes: tipos de formulações de OCR
De um modo geral, os produtos OCR podem ser caracterizados por sua funcionalidade ou composição. Resumidamente, algumas formas de dosagem de OCR possíveis incluem:
- Matrix - API é disperso em uma matriz de polímero
- Reservatório - o API está contido em um invólucro de polímero como um monólito ou multiparticulado
- Difusão - API difunde-se gradualmente através de uma membrana de polímero, como em um sistema de reservatório, ou através de uma matriz gelificada
- Erosão - API é liberado apenas quando a matriz ou revestimento se dissolve
- Monolith - o produto acabado é uma peça única
- Multiparticulado - o produto acabado contém uma população de grânulos
- Troca iônica - o API é liberado do complexo droga-resina na presença de um pH específico
- Osmótico - o núcleo do produto contém API e um agente osmótico, revestido com um polímero semipermeável; conforme a água penetra, a droga se dissolve e é empurrada para fora de um orifício no revestimento por pressão osmótica
- Híbridos - combinações de formatos
Ao longo dos anos, os prós e os contras de cada tipo do ponto de vista do desempenho tornaram-se claros, mas os vários tipos de formulação também vêm com uma série de outras considerações potencialmente importantes. As características a considerar que podem ou não ser importantes para a formulação proposta incluem:
- Estabilidade
- Custo
- Facilidade de mudança para escala de lote
- Facilidade de transferência de tecnologia
- Disponibilidade de experiência
- Disponibilidade de capacidade do equipamento
- Tempo do ciclo de fabricação
- Interações da API com outros componentes do produto
- Perfis de liberação complexos
- Aplicabilidade da tecnologia add-on (por exemplo, solubilidade, aumento da biodisponibilidade, mascaramento de sabor)
- Flexibilidade de força de dosagem
- Considerações especiais sobre a população: pediátrica, geriátrica, disfagia, polifarmácia
- Potencial de abuso / uso indevido
- Efeito da co-administração de álcool
- Potencial de falsificação
- Facilidade de variação, titulação ou redução gradual da dose em estudos clínicos
- Preenchimento com dose proporcional / aplicabilidade de bioisenção
- Carga de medicamento / tamanho da forma de dosagem
Um tablet ou uma cápsula funcionam melhor para seu aplicativo de OCR?
Neste artigo, não há espaço para abordar todas as possibilidades. Em vez disso, como exemplo, considere comprimidos de matriz hidrofílica e cápsulas multiparticuladas. Comprimidos e cápsulas são muito diferentes na formulação e no processo. Cada um tem prós e contras, dependendo dos efeitos desejados.
Os comprimidos de matriz hidrofílica monolítica são os produtos de OCR mais comuns. Cada um consiste em uma matriz de polímero que contém o API até que seja liberado por meio de difusão ou erosão da matriz.
O tipo mais comum de cápsula multiparticulada envolve uma ou mais populações de grânulos revestidos de Wurster em uma cápsula de gelatina dura de duas peças facilmente dissolvida.
Quais são alguns dos benefícios e limitações de cada abordagem?
Do ponto de vista do
paciente Para os pacientes, as cápsulas podem ser mais bem toleradas. As cápsulas são frequentemente mais fáceis de engolir do que os comprimidos ou cápsulas (comprimidos em forma de cápsula), embora o revestimento do comprimido ajude. Para pacientes com dificuldade de engolir, as cápsulas podem ser abertas e o conteúdo polvilhado sobre os alimentos e ainda assim liberado corretamente. Comprimidos, especialmente se não revestidos, podem ser mais propensos a irritação gástrica e degola na garganta.
Do aspecto de desenvolvimento de química, fabricação e controles (CMC), os
comprimidos monolíticos não são muito personalizáveis. Pode ser difícil ajustar seus perfis de dissolução, especialmente com mais de uma API. Como há apenas uma única matriz, vários APIs serão lançados junto com pouca latitude para ajustar o perfil de dissolução de um em relação ao outro. Se eles não forem compatíveis, você não pode protegê-los uns dos outros sem etapas de processamento adicionais, como revestir as partículas de API ou recorrer a um tablet multicamadas.
As cápsulas multiparticuladas OCR, por outro lado, podem ser criadas com padrões de dissolução complexos. Populações separadas de grânulos com diferentes padrões de liberação, como liberação imediata ou controlada, são desenvolvidas e combinadas, nas proporções desejadas.
Além disso, vários APIs podem ser facilmente separados uns dos outros ou liberados em momentos diferentes porque são fabricados como grânulos separados com taxas de dissolução distintas. Esse tipo de padrão de liberação complexo é impossível com um comprimido monolítico simples.
No entanto, essa personalização tem um custo. Cada tipo de cordão requer seus próprios esforços de desenvolvimento e sua própria etapa do processo, aumentando o tempo do ciclo de fabricação e os requisitos de teste em processo.
Do ponto de vista do desenvolvimento clínico
Depois que o novo medicamento entra no desenvolvimento clínico, um conjunto diferente de considerações entra em jogo. Freqüentemente, durante este estágio, uma mudança de dose ou uma mudança no padrão de liberação é necessária. Além disso, uma gama de dosagens pode ser necessária para titulação ou redução gradual.
É fácil presumir que mudar a dosagem ou alterar apenas um componente de um comprimido não afetará sua liberação, mas isso é incorreto. Depois de personalizar o perfil de lançamento de um tablet, alterar qualquer um desses elementos pode alterar o perfil de dissolução e pode exigir a repetição de todo o processo de desenvolvimento de lançamento. Na pior das hipóteses, você pode ter que reconsiderar a seleção do polímero, o tamanho do tablet e o conteúdo do API, possivelmente reformulando como se do zero.
Por outro lado, para cápsulas multiparticuladas, porque os APIs são embalados ordenadamente em suas próprias populações de grânulos, cada aspecto (dose ou perfil de liberação de componente) pode ser alterado independentemente dos outros atributos. Como cada população de grânulos se comporta de forma independente, alterar a quantidade ou composição de uma raramente afeta as outras.
O esvaziamento gástrico também afeta o desempenho das cápsulas muito menos do que os comprimidos. Se a liberação da dissolução ou a absorção da droga forem afetadas pelo esvaziamento gástrico, isso pode ser importante. O momento do esvaziamento gástrico para qualquer partícula ou comprimido individual é variável. Em um determinado momento, um comprimido ou sai do estômago ou não. Com uma cápsula multiparticulada, por outro lado, a qualquer momento, uma parte das contas provavelmente sairá do estômago enquanto outras permanecerão. Este comportamento estatístico da população suaviza o desempenho da cápsula, transformando o esvaziamento gástrico para a dose de um evento instantâneo sim / não para um tempo médio. Isso geralmente leva a resultados farmacocinéticos mais previsíveis de paciente para paciente.
Do ponto de vista da fabricação, as
matrizes monolíticas são simples, rápidas e relativamente baratas de fabricar. O equipamento envolvido pode ser tão simples quanto um liquidificador e uma prensa de comprimidos. Como o processo é simples, a transferência de tecnologia é relativamente fácil. Um lote pode ser produzido em algumas horas, e o tamanho do lote é limitado apenas pela capacidade da caixa de mistura. Tamanhos de lote pesando milhares de quilogramas não são incomuns. Graças às etapas limitadas do processo, os testes em processo podem ser reduzidos ao mínimo, economizando tempo de laboratório, tempo de ciclo de fabricação e, por fim, custo dos produtos.
Em alguns casos, as matérias-primas em pó podem não fluir bem. No entanto, adicionar uma etapa de granulação melhorará a uniformidade e o fluxo, tornando o processo de compressão mais eficiente. O uso de excipientes mais novos e formulados sob medida pode ajudar a facilitar ainda mais a fabricação, permitindo uma produção de lote mais rápida, melhor liberação e menor custo.
A fabricação de cápsulas multiparticuladas é geralmente mais complexa. Para cada API, uma população de grânulos é construída em torno das partículas do núcleo, como esferas de açúcar. Depois que o API é adicionado, cada grânulo é revestido com um filme de polímero de controle de liberação. O equipamento é menos comum e os processos mais complexos, dificultando a transferência de tecnologia e o aumento de escala. Uma vez que todas as populações necessárias de grânulos foram formadas, elas são misturadas nas proporções desejadas e colocadas em cápsulas de gelatina dura de duas peças.
A desvantagem da fabricação de cápsulas de OCR multiparticuladas é que ela é lenta, trabalhosa e cara devido às várias etapas do processo necessárias. Os grânulos são formados por meio de um processo de revestimento em camadas de várias etapas. Tamanhos de lote menores (centenas de quilogramas) e processamento mais longo (às vezes até 24 horas por etapa de revestimento) significa que a fabricação desse tipo de produto é mais cara e demorada do que a fabricação de comprimidos.
Uma nota sobre as formulações do reservatório
Além das estruturas de matriz, os comprimidos também podem ser construídos como reservatórios monolíticos: uma concha permeável construída em torno de um núcleo contendo o API em solução. Se o revestimento funcional falhar precocemente, entretanto, toda a dose do medicamento será liberada de uma vez. Esta descarga de dose normalmente leva a níveis sanguíneos mais elevados do que o desejado, efeitos colaterais, toxicidade e efeito de curta duração. Dependendo do API e da população de pacientes, esse risco pode variar de clinicamente insignificante a imediatamente fatal. É essencial obter informações médicas qualificadas para avaliar esse tipo de risco produto por produto e por indicação.
Reservatórios multiparticulados, com grânulos que são estruturados de forma semelhante, embora em uma escala muito menor, mitigam o risco de despejo de dose, distribuindo a dose em uma infinidade de reservatórios menores, cada um dos quais pode reter a carga de medicamento independentemente.
Principais diferenças entre comprimidos de matriz e cápsulas multiparticuladas para formulações de OCR
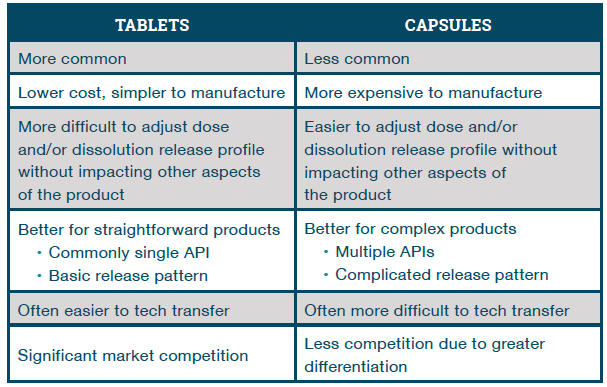
Novos desenvolvimentos
Fundamentalmente, os comprimidos e as cápsulas não são novos. No entanto, utilizar materiais e processos novos e combiná-los com tecnologias complementares inovadoras pode permitir a criação de produtos que antes não eram viáveis.
As tecnologias mais recentes incluem:
- Uma grande variedade de polímeros, com atributos variados (hidrofílico, hidrofóbico, dependente do pH, intumescimento / não intumescente) e uma gama de tamanhos de partícula
- Tecnologias de aumento de biodisponibilidade / solubilidade
- Excipientes formulados que simplificam o desenvolvimento e permitem um processamento mais rápido
- Camadas novas e mais rápidas e métodos de produção mais rápidos
- Métodos de fabricação contínua
Resolvendo quebra-cabeças de liberação controlada de drogas
Exemplos
Certas situações exigem perfis de dissolução específicos. Esses perfis são frequentemente obtidos usando combinações de componentes granulares de liberação imediata e retardada em cápsulas multiparticuladas.
E se você tiver um medicamento que induz tolerância em doses repetidas, mas para o qual a abstinência restaura a sensibilidade - e você deseja criar uma formulação de OCR dele? Considere uma combinação de medicamentos usada para tratar doenças vasculares, como angina, doença isquêmica do coração e hipertensão arterial. Ambos os seus constituintes, dinitrato de isossorbida e hidralazina, são propensos a induzir tolerância. A solução é fornecer dois a três pulsos separados desses APIs a partir de uma única cápsula diária. Uma composição pulsátil produz um perfil plasmático semelhante ao obtido pela administração sequencial de doses de liberação imediata, como em um regime de tratamento típico. Para obter esse efeito, são criadas populações de grânulos de liberação imediata e de liberação retardada para cada API. Combinar todos esses tipos de grânulos em uma única cápsula obtém o efeito desejado.
Efeitos cronoterapêuticos úteis também podem ser alcançados por meio de liberação retardada. Exemplos dessa estratégia incluem: uma dose noturna de verapamil, bloqueador dos canais de cálcio, formulado para entrega tardia no início da manhã para proteger o coração no horário mais frequente de ataques cardíacos; e um atraso de seis a oito horas, formulação noturna que libera um medicamento para artrite reumatóide no início da manhã para prevenir a rigidez matinal típica dessa doença.
Também podem ser formulados medicamentos para a dor de liberação prolongada e com duração de 12 a 24 horas. A liberação controlada elimina os picos do nível sanguíneo e seu potencial para efeitos colaterais aumentados, ao mesmo tempo que reduz os vales do nível sanguíneo, que apresentam o risco de baixa eficácia devido à dosagem insuficiente.
Conclusão
Para medicamentos orais de liberação controlada, os vários tipos de formas de dosagem oferecem vantagens e desvantagens distintas. As cápsulas multiparticuladas oferecem mais flexibilidade para entrega sofisticada e programada de vários APIs e para ajustes de dose durante os testes clínicos. No entanto, eles são caros e demorados para desenvolver e fabricar. Os comprimidos são mais rápidos e econômicos de desenvolver e fabricar, embora ajustar a dosagem e os perfis de liberação possa ser mais difícil.
Ao decidir qual dos muitos caminhos possíveis a seguir, os desenvolvedores devem considerar o quão complicado é seu produto e qual deve ser o seu preço para competir com outros produtos semelhantes no mercado. Produtos simples geralmente são mais bem projetados como tablets para reduzir os custos de fabricação que podem comprometer seu sucesso no mercado. Encontrar um parceiro com o máximo de experiência possível no trabalho com formulações sólidas de liberação controlada oral ajudará a garantir o sucesso no desenvolvimento de produtos de liberação controlada oral.





