Por Omar A. Salman, Ph.D., Conselheiro de Pesquisa Sênior, Pfizer CentreOne
A fabricação de suspensões aquosas estéreis requer uma compreensão completa dos fatores que influenciam sua estabilidade física e química. A morfologia das partículas do ingrediente farmacêutico ativo (API) desempenha um fator chave na taxa de dissolução do medicamento, ressuspensão e seringabilidade. O tipo e a concentração de surfactantes usados na formulação afetam a ressuspensão do medicamento e a estabilidade química. Além disso, as tecnologias usadas na redução do tamanho de partículas do API e na mistura de alto cisalhamento para formulação de medicamentos devem ser avaliadas devido ao seu impacto nos atributos de qualidade do API e do medicamento.
Uma revisão concisa desses fatores é apresentada neste artigo.
Processo de manufatura
Um diagrama de fluxo das principais etapas na fabricação de suspensões aquosas estéreis é ilustrado na Figura 1. O tamanho de partícula do API cristalizado assepticamente (não moído) é reduzido usando um moinho de jato de fluido, ou micronizador, para a distribuição de tamanho de partícula desejada perfil. Em um moinho de jato de fluido (Figura 2), a redução de tamanho é alcançada pela colisão partícula a partícula. As partículas de pó são alimentadas na câmara de moagem por um sistema Venturi. O jato de gás (nitrogênio ou ar) entra através de um conjunto de bicos De-Laval que aumentam a aceleração das partículas para atingir a velocidade supersônica (300-500 m/s). A colisão entre as partículas que entram na câmara de moagem e as partículas que se movem em espiral dentro da câmara resulta na quebra de partículas. Devido à força centrífuga, partículas mais finas saem pela parte central da câmara, enquanto partículas maiores na área do anel externo continuam a acelerar até que seu tamanho seja ainda mais reduzido por colisão [1]. Os principais parâmetros que afetam o tamanho das partículas são a taxa de alimentação do pó e a pressão do fluido do jato (pressão de moagem). O aumento da taxa de alimentação aumenta a concentração do produto na câmara do micronizador reduzindo assim o espaço de aceleração entre as partículas. Em geral, taxas de alimentação mais altas resultam em partículas mais grossas. Maior pressão de moagem significa maior energia de micronização, que produz partículas mais finas. O aumento da taxa de alimentação aumenta a concentração do produto na câmara do micronizador reduzindo assim o espaço de aceleração entre as partículas. Em geral, taxas de alimentação mais altas resultam em partículas mais grossas. Maior pressão de moagem significa maior energia de micronização, que produz partículas mais finas. O aumento da taxa de alimentação aumenta a concentração do produto na câmara do micronizador reduzindo assim o espaço de aceleração entre as partículas. Em geral, taxas de alimentação mais altas resultam em partículas mais grossas. Maior pressão de moagem significa maior energia de micronização, que produz partículas mais finas.
O API micronizado é embalado em bolsas Tyvek ® e depois esterilizado usando um esterilizante a gás, por exemplo, óxido de etileno. A esterilização por irradiação gama ou feixe de elétrons só pode ser usada se essas tecnologias não tiverem impacto na qualidade do produto. Por exemplo, geralmente, a irradiação não é viável para corticosteróides devido à degradação radiolítica [2]. O API esterilizado terminal é então adicionado assepticamente em uma área de Grau A ao veículo estéril, e a suspensão é misturada usando um misturador de alto cisalhamento para dispersar totalmente e molhar as partículas.
A etapa final do processo de fabricação é o enchimento. Os frascos pré-esterilizados são preenchidos com um volume fixo de suspensão usando um sistema totalmente automatizado, depois selados com uma rolha e tampa.
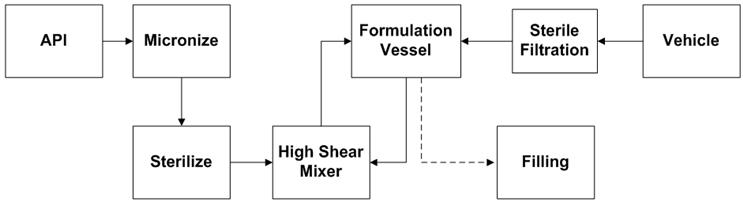
Figura 1: Fluxograma do processo de formulação de suspensão estéril
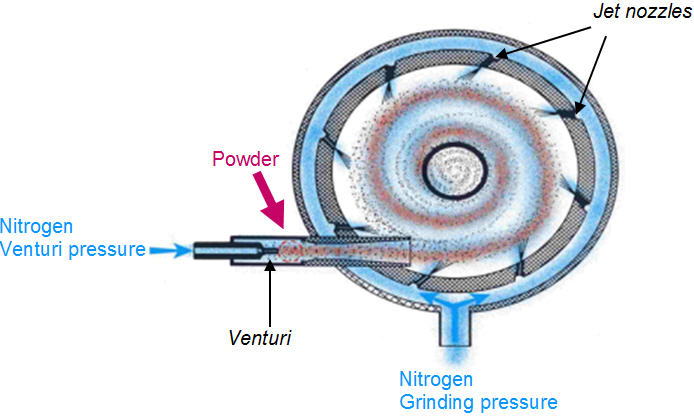
Figura 2: Diagrama esquemático do processo de micronização usando um moinho de jato de fluido [1]
Características da API
O tamanho das partículas desempenha um papel fundamental na estabilidade das suspensões. Partículas grandes têm uma taxa de sedimentação mais rápida, de acordo com a lei de Stokes, e podem entupir a agulha durante a retirada da suspensão do frasco ou na injeção, resultando em dosagem inadequada. As partículas finas, por outro lado, formam uma torta no fundo do frasco que é difícil de dispersar se não forem devidamente unidas durante a formulação.
Além disso, a distribuição do tamanho das partículas afeta a taxa de dissolução do fármaco conforme descrito pela equação de Noyes-Whitney:
dC/dt= (C s -C) DA/Vh (1)
onde, dC/dt = taxa de dissolução, D = coeficiente de difusão, A = área de superfície da partícula, C s = solubilidade, C = concentração no tempo t, V = volume da solução eh = espessura da camada limite. À medida que o tamanho das partículas é reduzido, a área superficial aumenta aumentando assim a taxa de dissolução e consequentemente a biodisponibilidade.
Formulação do veículo
Os principais componentes de um veículo de base aquosa são:
- um agente umectante para substituir a interfase ar-sólido por uma interfase líquido-sólido
- um surfactante para formar uma suspensão termodinamicamente estável superando as forças atrativas do tipo Van Der Waals entre partículas
- cloreto de sódio para isotonicidade
- um conservante, como álcool benzílico
- antioxidante, e
- um tampão se o controle de pH for necessário
O polietilenoglicol 3350 (PEG) é um tensoativo não iônico solúvel em água que possui a fórmula química de HO(CH 2 CH 2 O) nH e é comumente usado na formulação de veículos para fornecer estabilização estérica da suspensão. Segmentos de polímero PEG, referidos como cadeias de “ancoragem”, são adsorvidos à superfície das partículas de API para formar uma camada de adsorção. A espessura dessa camada depende de vários parâmetros, como concentração do polímero, solvência do meio, temperatura e peso molecular do polímero. Os outros segmentos, referidos como cadeias estabilizadoras ou “caudas” estendem-se para a solução [3]. Essas caudas se interconectam para fazer a ponte entre as partículas, resultando em floculação controlada. Uma comparação entre a distribuição de tamanho de partícula do API antes e depois da formulação ilustra claramente o fenômeno de ponte (Figura 3). Observe que as suspensões que contêm partículas extremamente finas (nanopartículas) são geralmente estáveis e não requerem a adição de surfactantes. O movimento browniano das partículas neutraliza a força gravitacional de tal forma que as partículas permanecem suspensas no meio. À medida que as partículas se tornam mais grossas, elas se depositam e formam sedimentos compactos que são difíceis de redispersar se nenhum surfactante for adicionado ao veículo [4]. Se um surfactante é adicionado, no entanto, o pó se deposita como partículas com pontes frouxas que são fáceis de redispersar.
A concentração de surfactante desempenha um papel crítico na redispersibilidade do fármaco. Adicionar mais do que a quantidade ideal pode ter efeitos adversos, como aglomeração. A Figura 4 compara a distribuição de tamanho de partícula de suspensões em níveis crescentes de um tensoativo iônico. O tamanho médio de partícula da suspensão diminuiu de 23,5µ para 9,2µ e para 3,9µ, à medida que a concentração de surfactante aumentou de 0,117 mg/mL, para 0,233 mg/mL e para 1,165 mg/mL, respectivamente. Uma tendência semelhante foi observada para a altura do fármaco sedimentado (SDH), definida como o volume de API sedimentado sobre o volume total da suspensão e é considerado um marcador de redispersibilidade. O SDH diminuiu de 51% em uma concentração de surfactante de 0,117 mg/mL para 12% em uma concentração de surfactante de 1,165 mg/mL. Mais longe,
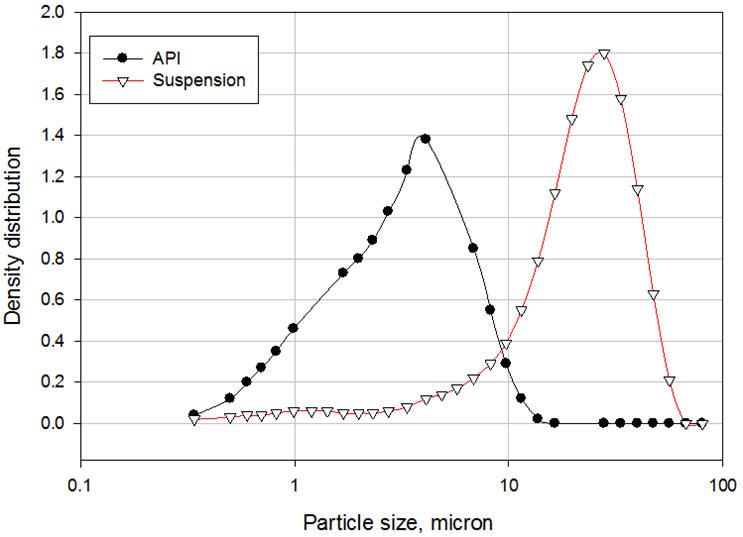
Figura 3: Distribuição de tamanho de partícula de API e suspensão
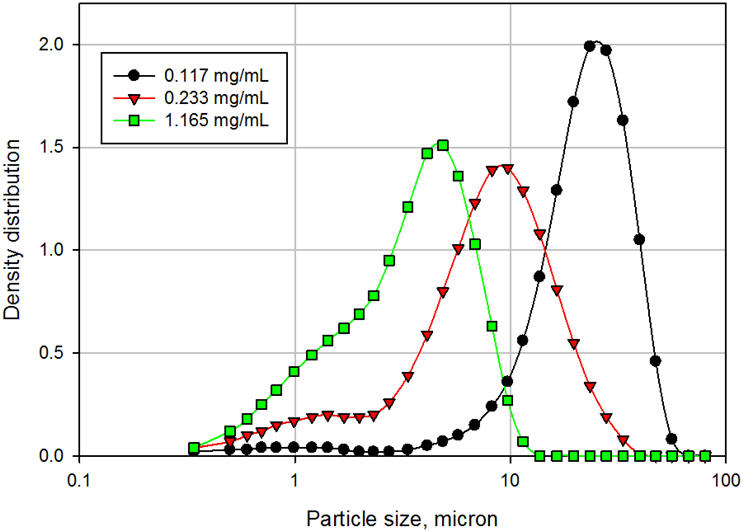
Figura 4: Distribuição de tamanho de partícula de suspensões em função da concentração de surfactante
O PEG e surfactantes semelhantes, como polissorbatos, no entanto, são conhecidos por serem suscetíveis à auto-oxidação para formar hidroperóxidos seguidos pela degradação da cadeia em subprodutos, como o ácido fórmico. Donbrow et ai. [5] mostraram que soluções aquosas de polissorbato 20 se degradam devido à autooxidação, e a degradação está associada a um aumento no número de peróxidos e uma queda no pH devido à formação de ácido. A taxa de formação de ácido aumentou em temperaturas mais altas. Em um estudo semelhante, Donbrow et al. [6] concluíram que os ácidos fórmico e acético foram formados devido à degradação da extremidade hidrofílica de polioxietileno de tensoativos não iônicos. Esses ácidos são formados na etapa de terminação da degradação por radicais livres da fração de oxietileno. Concluiu-se também que a taxa de formação de ácido aumentou a uma temperatura de incubação mais elevada.
O seguinte mecanismo foi sugerido:
| Iniciação | RH → R . + H. |
| Propagação | R. _ + O 2 → ROO .
ROO . + RH → ROOH + R . |
| Terminação | 2ROO . → Produtos inativos
ROO . + R. → Produtos inativos |
Na etapa de iniciação, os radicais livres são formados devido à luz, calor, iniciadores químicos ou catalisadores. Na segunda etapa, a propagação, o radical à base de carbono (R . ) reage com o oxigênio, formando um peróxido orgânico (ROO . ) que reage com o substrato (RH) para produzir um ácido e um novo radical de carbono para repetir as etapas de propagação . Na etapa de terminação, os radicais livres são desativados por colisões bimoleculares [5-7].
Além da queda de pH, a degradação do surfactante pode resultar no espessamento da suspensão, levando a problemas de uniformidade de conteúdo. Para lidar com a queda de pH causada pela degradação oxidativa do PEG, o ar no headspace do frasco é substituído por nitrogênio ou um agente tampão é adicionado à formulação.
Mistura de alto cisalhamento
Para molhar e dispersar totalmente o API no veículo, é necessária uma mistura de alto cisalhamento para que os surfactantes possam efetivamente adsorver na superfície de cada partícula. Vários tipos de misturadores de alto cisalhamento podem ser usados. Misturadores do tipo rotor-estator de lote (por exemplo, IKA ® , Silverson ® , Ystral ® ) são geralmente usados em laboratório, piloto e embarcações de produção de pequeno volume. Para equipamentos de grande escala, misturadores do tipo em linha, como Tri-Blender ® ou Ystral TDS ®(sistema de transporte e dispensação). No projeto Tri-Blender [8], uma bomba centrífuga é usada para puxar o pó de uma tremonha localizada na parte superior através de um tubo difusor para uma câmara de mistura onde o impulsor está localizado. O veículo é bombeado do tanque de formulação e entra tangencialmente através de um tubo externo para a câmara de mistura. A suspensão é então devolvida ao tanque. No sistema TDS [9], o pó é introduzido verticalmente por alto vácuo gerado por um rotor de alta velocidade. O líquido (veículo) é puxado do fundo do tanque de formulação para a câmara de distribuição do lado oposto da entrada do pó. Na câmara de dispersão, o pó é disperso no líquido sob taxas de cisalhamento muito altas e a suspensão é reciclada para o tanque.
Uma nova tecnologia promissora que pode ser usada tanto para mistura de alto cisalhamento quanto para redução de tamanho de partícula é o Microfluidizer ®Processador. Uma vantagem chave desta tecnologia é a eliminação da etapa de micronização de trabalho intensivo. Consequentemente, a redução de tamanho e a formulação podem ser realizadas em uma única etapa. O componente central desta tecnologia é a câmara de interação. A câmara possui microcanais com dimensões tão pequenas quanto 50µ através dos quais o fluido flui em velocidades de até 500 m/s. O exterior da câmara é feito de aço inoxidável, enquanto o interior é feito de diamante ou cerâmica. Um diagrama esquemático do Processador Microfluidizador é mostrado na Figura 5 [10]. O veículo e as partículas grossas de API são adicionadas a um recipiente de alimentação. A bomba intensificadora empurra a suspensão através da câmara de interação a pressões de até 40.000 psi. As altas forças de cisalhamento, colisão partícula-partícula e colisão partícula-parede resultam na redução do tamanho da partícula. A suspensão é resfriada por um trocador de calor e é coletada em um recipiente receptor ou reciclada para o recipiente de alimentação para mais passagens, dependendo do tamanho da partícula alvo. Esta tecnologia pode reduzir o tamanho das partículas para menos de 1µ.
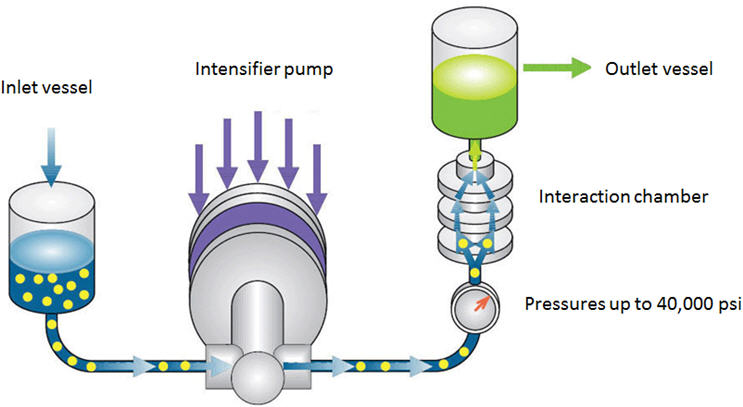
Figura 5: Diagrama esquemático do Processador Microfluidizador [10]
Um exemplo típico da aplicação do Processador Microfluidizador na fabricação de suspensão é discutido aqui. O veículo e o pó API não moído grosseiro foram adicionados a um recipiente de alimentação agitado do processador de microfluidizador de escala piloto modelo 110-EH. A suspensão foi recirculada através da câmara de interação H10Z que possui microcanais de 100μ a uma pressão de 20.000 psi por 6 minutos. As amostras foram removidas após 2, 4 e 6 minutos de recirculação para medir a distribuição do tamanho das partículas por difração a laser. Para medir o tamanho das partículas primárias, as amostras foram sonicadas por 30 segundos para quebrar a ponte entre as partículas. Os resultados são mostrados na Figura 6. O tamanho médio das partículas diminuiu de 157,71µ para o API não moído para 5,89µ após apenas 2 minutos de recirculação. Após 4 e 6 minutos de recirculação, o tamanho médio das partículas caiu para 3,35µ e 2,73µ, respectivamente. A suspensão final apresentou excelente redispersibilidade necessitando de apenas 1 inversão para suspender totalmente o API após 24 horas de sedimentação. Além disso, a suspensão passou no teste padrão de seringabilidade. A ponte das partículas na suspensão final é claramente ilustrada na Figura 7. O tamanho médio das partículas da suspensão antes da sonicação (como está) foi de 12,31µ. Após a sonicação, o tamanho médio das partículas foi de 2,73µ, o que representa o tamanho das partículas primárias. A ponte das partículas na suspensão final é claramente ilustrada na Figura 7. O tamanho médio das partículas da suspensão antes da sonicação (como está) foi de 12,31µ. Após a sonicação, o tamanho médio das partículas foi de 2,73µ, o que representa o tamanho das partículas primárias. A ponte das partículas na suspensão final é claramente ilustrada na Figura 7. O tamanho médio das partículas da suspensão antes da sonicação (como está) foi de 12,31µ. Após a sonicação, o tamanho médio das partículas foi de 2,73µ, o que representa o tamanho das partículas primárias.
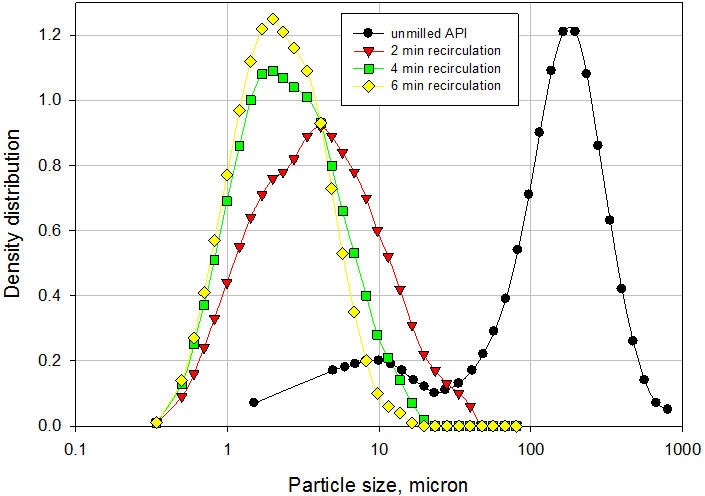
Figura 6: Distribuição de tamanho de partícula da suspensão formulada usando o Processador Microfluidizador
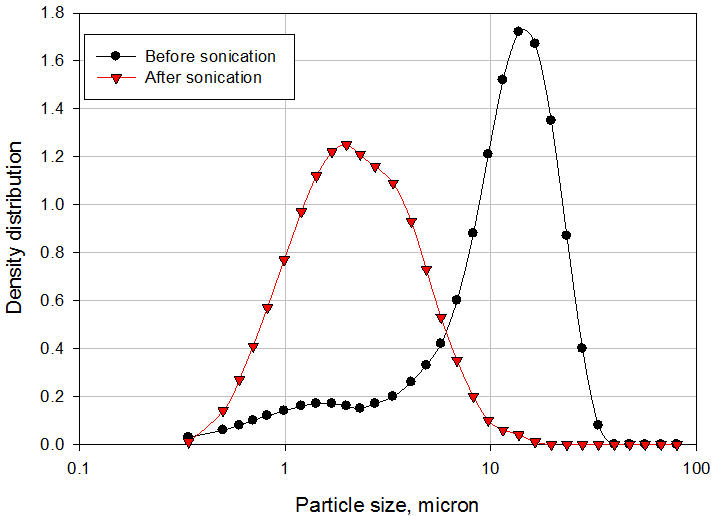
Figura 7: Distribuição de tamanho de partícula de partículas primárias e em ponte
Simulação de dinâmica molecular
A simulação de dinâmica molecular (MD) é um método em mecânica estatística que envolve a solução da segunda lei do movimento de Newton sob certas restrições para todos os átomos e moléculas do sistema em estudo. As simulações de MD podem ser usadas para prever o mecanismo de adsorção e a cinética de um surfactante na superfície dos cristais de API. Usando o campo de força CHARMM36 [11] e o servidor CgenFF [12] para os arquivos de parâmetros e topologia do PEG e da API, simulações MD foram realizadas para investigar a adsorção de cadeias de PEG 25-mer na superfície de um cristal de corticosteróide. Instantâneos de moléculas de PEG com todos os seus átomos em vermelho em uma solução aquosa no tempo = 0 e após 6 nanossegundos são ilustrados na Figura 8 (superior) e (inferior), respectivamente. As contas cinzentas representam átomos nas moléculas de corticosteróides em placas de cristal em ambos os lados. As moléculas de água não são mostradas para maior clareza. Essas simulações apoiam claramente o mecanismo discutido anteriormente. Um lado da molécula de PEG (provavelmente o hidrofóbico) adsorve na superfície do cristal enquanto o outro lado (provavelmente o hidrofílico) se estende no líquido.
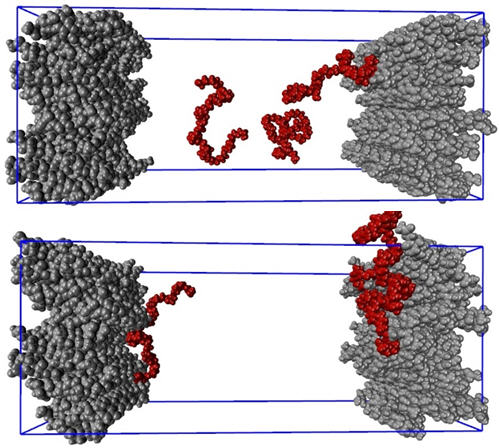
Figura 8: Adsorção da cadeia PEG de 25 mer (vermelho) no cristal API (pilhas cinza em ambos os lados)
Resumo
As principais operações unitárias na fabricação de suspensões aquosas estéreis são a redução do tamanho das partículas, formulação do veículo, esterilização e mistura de alto cisalhamento. Todas essas operações podem afetar as propriedades, bem como a estabilidade das suspensões. A taxa de dissolução do fármaco e a taxa de sedimentação são uma função do tamanho da partícula. O tipo e a concentração de tensoativos utilizados na formulação influenciam a ressuspensão da suspensão. A mistura de alto cisalhamento é fundamental para umedecer e dispersar as partículas durante a formulação.
Referências
- www.dec-group.net
- MP Kane, K. Tsuji. Esquema de degradação radiolítica para 60 corticosteróides co-irradiados. Jornal de Ciências Farmacêuticas, 72 (1), 1983.
- T. Tadros. Forças de interação entre partículas contendo camadas de polímero enxertadas ou adsorvidas. Advances in coloidal Interface Science, 104, 2003.
- T. Tadros. Controle de estabilidade/floculação e reologia de suspensões concentradas. Pure & Appl.Chem., 64 (11), 1992.
- M. Danbrow, E. Azaz, A. Pillersdrof. Autooxidação de Polissorbatos. J. Farmácia. Sci., 67 (12), 1978.
- M. Danbrow, R. Hamburger, E. Azaz, Pillersdorf. Desenvolvimento de Acidez em Surfactantes Não Iônicos: Ácido Fórmico e Acético. Analista, 103, 1978.
- B. Kerwin. Polissorbato 20 e 80 Utilizado na Formulação de Bioterapêuticos de Proteínas: Estrutura e Vias de Degradação. J. Farmácia. Sci, 97 (8), 2008.
- Boletim técnico. Tri Clover, Inc.
- http://ystral.com/
- www.microfluidicscorp.com .
- http://mackerell.umaryland.edu/charmm_ff.shtml#gromacs
- https://cgenff.paramchem.org/
Fonte: Pfizer CentreOne Contract Manufacturing