Carbonato de cálcio como substituto do dióxido de titânio em revestimentos: a importância da engenharia de partículas
Os revestimentos brancos e coloridos uniformes aplicados aos comprimidos criam uma aparência homogênea entre os lotes, melhorando a estética e a adesão do paciente. O dióxido de titânio é amplamente utilizado em formas farmacêuticas sólidas para esse fim, servindo como opacificante e corante. Devido ao seu alto índice de refração, proporciona maior opacidade e cobertura para um revestimento .
Com base em uma avaliação de segurança do dióxido de titânio (E171) pela Autoridade Europeia para a Segurança dos Alimentos (EFSA)1 em relação a preocupações sobre possíveis efeitos genotóxicos, a Comissão da UE retirou a autorização para usar dióxido de titânio em alimentos e suplementos dietéticos. A proibição do dióxido de titânio entrou em vigor em agosto de 2022 com base no Regulamento da Comissão (UE) 2022/63 e sua remoção de produtos farmacêuticos na UE está sendo considerada.2 Uma possível proibição teria um grande impacto, pois estima-se que 91.000 medicamentos humanos contêm dióxido de titânio.3
Dadas essas tendências regulatórias, é necessário identificar substitutos sustentáveis para o dióxido de titânio. Com o status de aprovação atual como o único outro corante branco para drogas na UE, o carbonato de cálcio é visto como a alternativa mais provável. O excipiente Parteck® TA – um carbonato de cálcio com uma morfologia definida e distribuição de tamanho de partícula – da Merck foi desenvolvido para uso em revestimentos de filme de comprimido e atende à necessidade de boa opacidade e eficiência do processo.
Este white paper destaca como a engenharia de partículas oferece suporte a um desempenho ideal de carbonato de cálcio em aplicações de revestimento, comparando o excipiente Parteck® TA com o dióxido de titânio de referência do setor.
Propriedades Físicas e Caracterização
A seleção de um grau adequado de carbonato de cálcio para formulações de revestimento requer uma compreensão detalhada do papel que a morfologia e o design das partículas desempenham no processo de desenvolvimento.
A opacidade dos pigmentos brancos deve-se em grande parte à sua capacidade de dispersar a luz incidente. A dispersão depende de vários fatores, incluindo as propriedades ópticas das partículas e seu tamanho de partícula, forma, estrutura de superfície, orientação espacial e arranjo de partículas.4

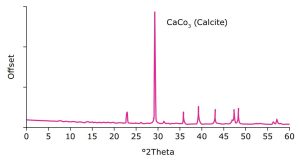
Neste estudo, o carbonato de cálcio Parteck® TA foi caracterizado por microscopia eletrônica de varredura (SEM) e difração de raios X em pó (PXRD). O produto de engenharia de partículas fornece uma morfologia de partícula única, conforme demonstrado nas imagens SEM (Figura 1).
Seu padrão específico no difratograma corresponde à morfologia da calcita com estrutura romboédrica e cristais hexagonais frequentes, conforme confirmado por medidas de PXRD (Figura 2).
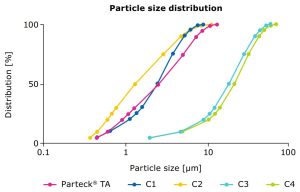
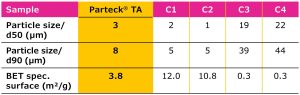
Uma boa cobertura de núcleos de comprimidos pode ser alcançada por uma faixa otimizada da distribuição de tamanho de partícula (PSD, Figura 3 e Tabela 1); uma redução do tamanho da partícula até certo ponto pode aumentar as propriedades de dispersão de luz e, portanto, a opacidade das partículas.4 Como um benefício adicional, um PSD definido pode garantir um desempenho consistente e minimizar a variação de lote para lote.
Tabela 1.
Tamanhos de partícula e áreas de superfície específicas BET do excipiente Parteck® TA versus outras amostras de mercado (C1–C4). Tamanho de partícula medido usando difração a laser; superfície da partícula medida de acordo com BET (Brunauer, Emmett e Teller) usando o método de adsorção de nitrogênio.
Pré-triagem com cartões de saque
Para simplificar o processo de desenvolvimento do revestimento de filme e o design da formulação, métodos de triagem dedicados podem ser usados. A fundição do filme em cartões de cores definidas permite uma avaliação rápida da opacidade em pequena escala sem a necessidade de testes de revestimento. A opacidade equivale ao poder de cobertura de um pigmento, enquanto o grau de opacidade de um filme é definido pela razão da refletância da luz incidente sobre um fundo preto e um fundo branco. No caso de uma cobertura completa do cartão de cor preta, a opacidade é de 100%.
A Figura 4 mostra os resultados de uma etapa de pré-triagem, realizada com filmes desenhados em cartões preto e branco. Em comparação com os filmes contendo dióxido de titânio, uma cobertura semelhante pode ser obtida com o excipiente Parteck® TA usando concentrações mais altas.

Formulação de base: solução Parteck® COAT (20%)
Espessura do filme: 0,08–0,15 mm
Aplicador de filme de cartão: Moeller, CI-K3-125-M
Aplicação em revestimentos de filme de comprimido
Para a simulação de substâncias medicamentosas coloridas, os núcleos dos comprimidos foram fabricados com um teor de 0,5% de óxido de ferro vermelho. Essa abordagem imita um cenário desafiador apresentado por uma substância medicamentosa de cor forte e distribuída heterogeneamente dentro do núcleo do comprimido. Os processos de revestimento foram realizados em um tambor rotativo
revestidor tipo LDCS (Vector Freund Corporation). Para o
estudo comparativo, foi objetivo investigar a cobertura dos revestimentos de filme, a distribuição na superfície do comprimido e as propriedades galênicas dos comprimidos revestidos.
Núcleos do tablet:
Formulação padrão: 98% manitol, 1,5% estearato de magnésio, 0,5% óxido de ferro vermelho
Óxido de ferro vermelho: Usado para demonstrar o desempenho da opacidade
Comprimidos convexos: 500 mg de peso, 11 mm de diâmetro; compressão realizada com a prensa de comprimidos Fette 1200i (Fette Compacting GmbH)Suspensão de revestimento:
10% de talco, 20% de citrato de trietilo; a quantidade de HPMC e Parteck® COAT (PVA) foi adaptada às formulações individuais
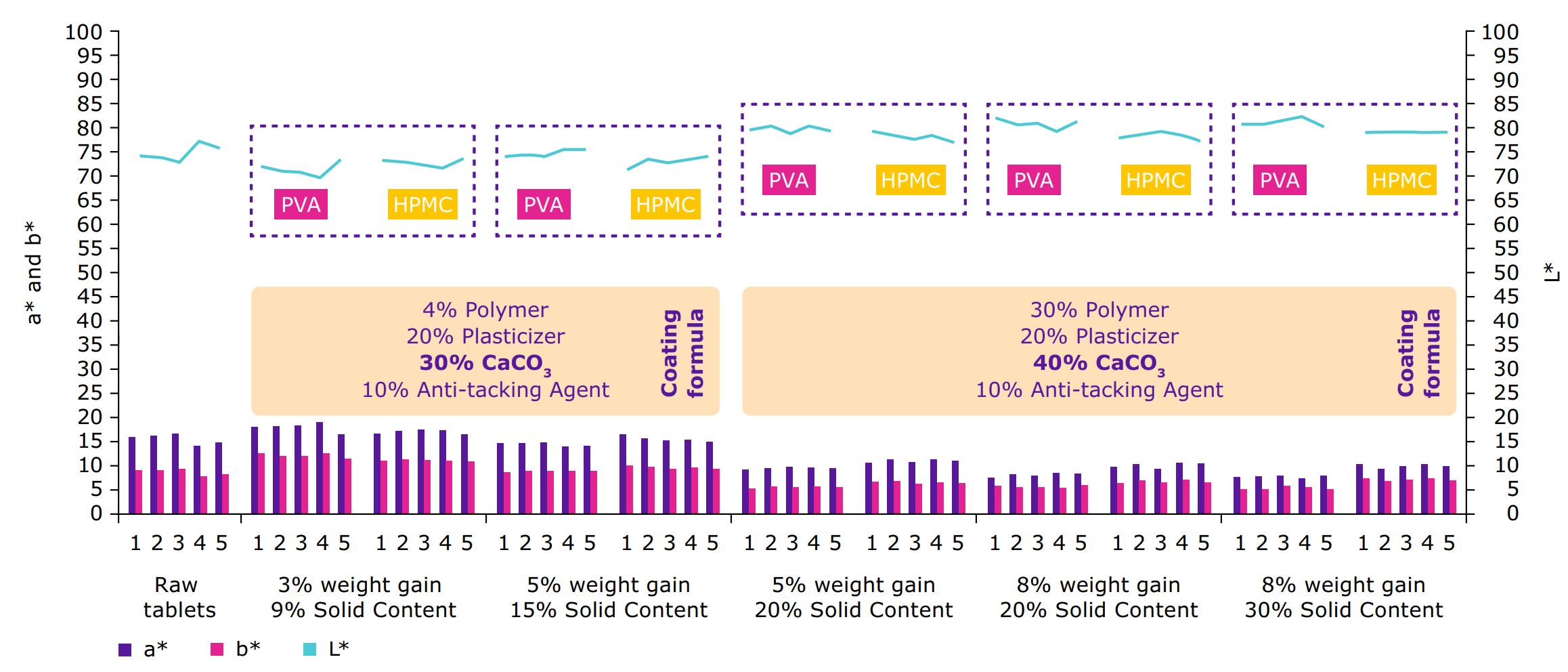
Cobertura dos revestimentos de filme
A cobertura aprimorada dos comprimidos principais pode ser alcançada
por um aumento de peso do comprimido (Figura 5). Um
ganho de peso de 5-8% foi tipicamente suficiente para cobrir a maior parte
a substância de droga fortemente colorida. Um limite de carregamento
de até 20% de ganho de peso do comprimido foi avaliado para
fins de informação.

Distribuição na superfície do tablet
As fotos SEM da superfície e do corte do comprimido mostram uma distribuição homogênea das partículas de carbonato de cálcio no revestimento (Figura 6) e em toda a área do revestimento.

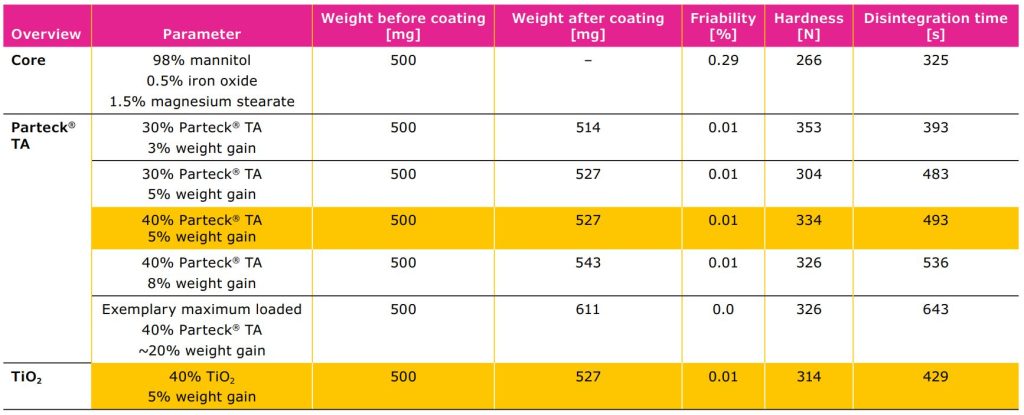
propriedades galênicas
De acordo com os resultados do estudo, as propriedades galênicas dos comprimidos com carbonato de cálcio Parteck® TA (5%
de ganho de peso) foram semelhantes às dos comprimidos com dióxido de titânio (5% de ganho de peso). Nenhum impacto na friabilidade ou dureza do comprimido
foi observado (Tabela 2).
Baixe o White Paper completo sobre “ Carbonato de cálcio como substituto do dióxido de titânio em revestimentos: a importância da engenharia de partículas ” aqui
(clique na imagem para baixar o White Paper)
Fonte: Merck White Paper “Carbonato de cálcio como substituto do dióxido de titânio em revestimentos: a importância da engenharia de partículas”