Mini-tablets: uma estratégia válida para combinar eficácia e segurança em pediatria

No tratamento de doenças pediátricas, as formas farmacêuticas produzidas em massa geralmente não são adequadas para crianças. Medicamentos comercialmente disponíveis são comumente manipulados e misturados com alimentos pelos cuidadores em casa, ou medicamentos extemporâneos são rotineiramente manipulados nas farmácias hospitalares para tratar crianças hospitalizadas. Apesar dos esforços consideráveis das agências reguladoras, a população pediátrica ainda está exposta a práticas questionáveis e potencialmente prejudiciais.
Ao projetar medicamentos para crianças, a capacidade de ajustar a dosagem, garantindo a segurança dos ingredientes, é de suma importância. Para estes fins, as formulações sólidas podem representar uma alternativa válida às formulações líquidas por sua fórmula mais simples e mais estabilidade e, para superar o problema da capacidade de intumescimento, os mini-comprimidos podem ser uma opção viável.
Esta revisão trata das diferentes abordagens que podem ser aplicadas para desenvolver mini-comprimidos destinados à pediatria com foco na segurança dos excipientes. A par do método convencional de compressão, a impressão 3D mostrou-se particularmente apelativa, pois permite reduzir o número de ingredientes e evitar tanto a mistura de pós como etapas intermédias como a granulação. Assim, esta técnica poderá ser bem adaptável às preparações galénicas diárias de uma farmácia hospitalar, conduzindo assim a uma redução da prática comum das preparações off-label.
continue lendo aqui
Sobre este artigo: Zuccari, G.; Alfei, S.; Marimpietri, D.; Iurilli, V.; Barabino, P.; Marchitto, L. Mini-tablets: uma estratégia válida para combinar eficácia e segurança em pediatria. Produtos farmacêuticos 2022, 15, 108. https://doi.org/10.3390/ph15010108
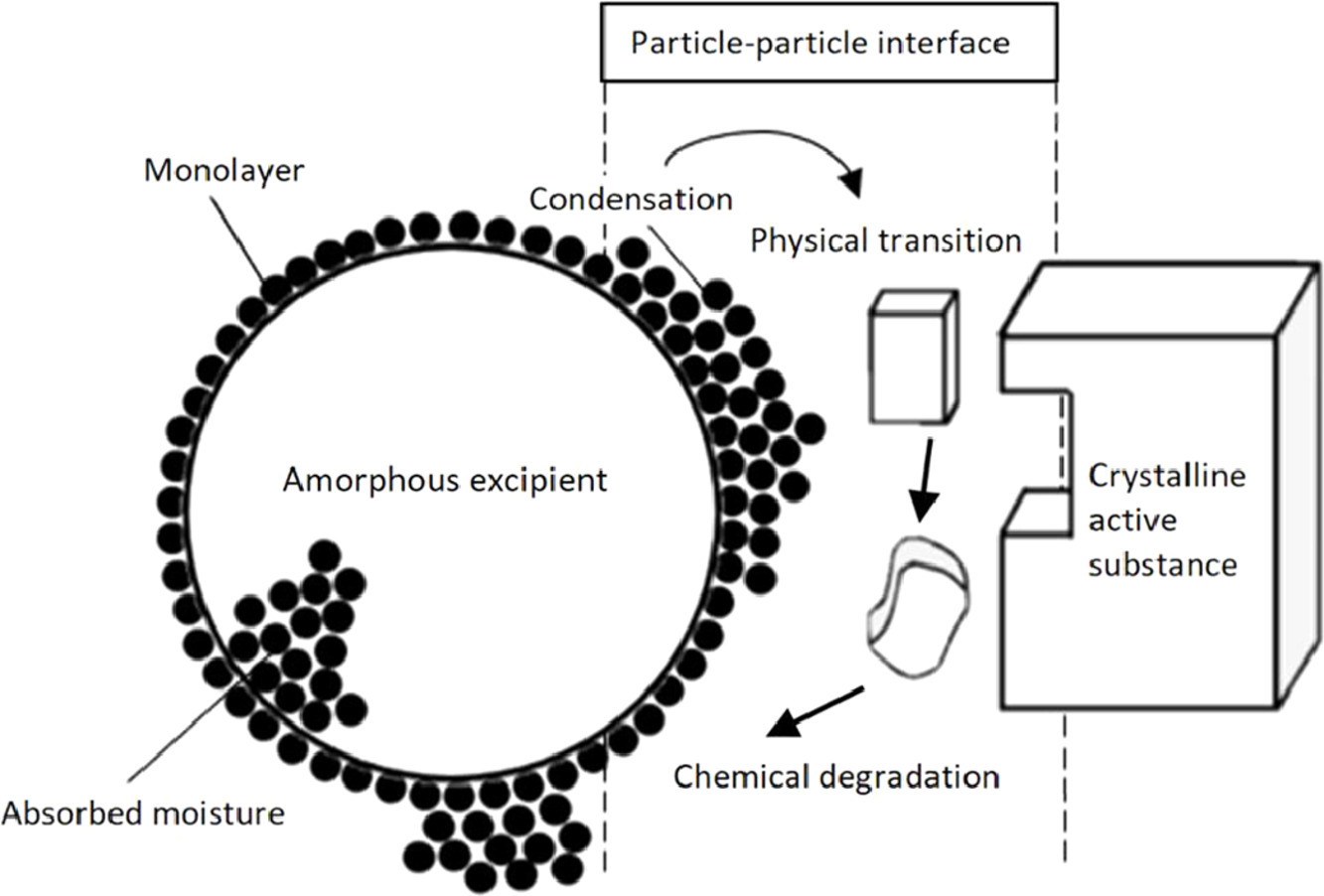
Trecho sobre Excipientes da publicação
Excipientes Apropriados para Pediatria
Em princípio, quase todas as formulações de medicamentos contêm excipientes que têm sido usados por muitos anos e são considerados geralmente considerados seguros (GRAS). São descritos em monografias em diversas farmacopeias e liberados com certificados de análises, realizadas segundo métodos de ensaio de monografias, que garantem sua qualidade. Em qualquer caso, as especificações incorporadas nas monografias destinam-se a cobrir o uso em adultos e não em crianças. Consequentemente, embora existam diferenças significativas na farmacocinética e farmacodinâmica entre as duas populações de pacientes, é prática comum supor que os excipientes, que não causaram reações adversas em adultos, são seguros também em recém-nascidos e/ou crianças. Nos últimos anos, a consciência de que alguns excipientes são menos bem tolerados em crianças, especialmente em neonatos cujos sistemas fisiológicos ainda estão em desenvolvimento, tornou-se conhecido pela intervenção das autoridades reguladoras. De fato, alguns recém-nascidos podem não conseguir depurar um excipiente com a mesma taxa que os adultos, como nos casos de fenilcetonúria. Portanto, não apenas a escolha da formulação mais adequada, mas também a seleção dos excipientes representam fatores-chave no desenvolvimento de formas farmacêuticas pediátricas adequadas. Na diretriz da EMA, é declarado como a seleção de um excipiente seguro pode ser realizada [ não só a escolha da formulação mais adequada, mas também a seleção de excipientes representam fatores-chave no desenvolvimento de formas farmacêuticas pediátricas adequadas. Na diretriz da EMA, é declarado como a seleção de um excipiente seguro pode ser realizada [ não só a escolha da formulação mais adequada, mas também a seleção de excipientes representam fatores-chave no desenvolvimento de formas farmacêuticas pediátricas adequadas. Na diretriz da EMA, é declarado como a seleção de um excipiente seguro pode ser realizada [9 ]. Ao projetar uma nova formulação, a diretriz da EMA sugere que um determinado excipiente deve ser escolhido com base nas fontes listadas abaixo em ordem hierárquica. Diretrizes da Comissão, ICH e EMA
- Pareceres científicos do CHMP
- Já autorizado em medicamentos pediátricos com composição quantitativa conhecida
- Incluído na Legislação Alimentar Europeia ou Incluído nos pareceres da EFSA
- Outras fontes, como o comitê de especialistas em aditivos alimentares (JECFA), indexado
- Literatura ou evidência científica interna