Embalagem Boas Práticas de Fabricação (BPF) para Medicamentos

O seu fornecedor de materiais de embalagem primária para medicamentos estabeleceu e implementou - e continuou a manter - um sistema de gestão da qualidade (SGQ) adequado? Geralmente, a maioria dos fornecedores de materiais de embalagem mantém um SGQ ISO 9001. No entanto, os requisitos da ISO 9001 podem não fornecer os níveis necessários de boas práticas de fabricação (BPF) e rigor para garantir que os materiais de embalagem sejam adequados para o uso pretendido.
Tipos de embalagem
Existem três tipos de embalagem: primária, secundária e terciária. Cada tipo de embalagem possui requisitos, riscos e usos exclusivos.
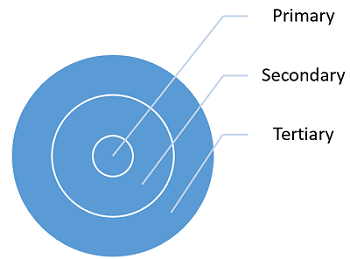
Figura 1: Tipos de materiais de embalagem e sua relação
A embalagem primária foi projetada para fornecer proteção contra a transmissão excessiva de umidade ou solventes para dentro ou para fora do produto, fornecer proteção contra luz para o produto, fornecer proteção microbiológica adicional, protegendo o produto contra invasões microbianas e proteger contra a transmissão excessiva de gases reativos ( oxigênio atmosférico, gás inerte de preenchimento do headspace ou outros vapores orgânicos) dentro ou fora do produto. Exemplos de embalagens primárias incluem frascos, seringas, ampolas, rolhas, tampas, frascos, bolsas e bolhas.
O principal objetivo da embalagem secundária é exibir a marca, propósitos logísticos e proteger e agrupar unidades individuais durante o armazenamento. A embalagem secundária também inclui embalagens feitas propositadamente para exibir várias unidades de produtos à venda, o que acelera o reabastecimento do depósito para a prateleira; essa embalagem inclui embalagem pronta para varejo, embalagem pronta para prateleira ou unidades de exibição de bancada. Exemplos de embalagens secundárias incluem bolsas, caixas e bandejas.
A embalagem terciária facilita a proteção, manuseio e transporte de uma série de unidades de vendas ou pacotes secundários, a fim de agrupar tudo em cargas unitárias durante o transporte. Esse tipo de embalagem raramente é visto pelo consumidor. Exemplos de embalagens terciárias incluem caixas, sacolas, embalagens retráteis e paletes.
Os componentes de embalagem podem ser feitos usando papel, papelão, plásticos (rígidos e flexíveis), materiais naturais, metal e vidro e uma infinidade de processos de produção modernos, incluindo moldagem por injeção, moldagem por sopro elástico, negrito por extrusão, moldagem por sopro por injeção, moldagem por compressão, formação a vácuo, extrusão, filmes soprados, laminação, conversão, etc.
ISO 15378: 2017
ISO 15378: 2017 Materiais de embalagem primários para medicamentos - Requisitos específicos para a aplicação da ISO 9001: 2015, com referência às boas práticas de fabricação (BPF), especificam requisitos para um SGQ quando uma organização precisa demonstrar sua capacidade de fornecer produtos e serviços de forma consistente que atendam aos requisitos estatutários e regulamentares aplicáveis do cliente, com o objetivo de aumentar a satisfação do cliente por meio de sistemas eficazes, melhoria contínua e comprometimento com o cliente e requisitos estatutários e regulamentares aplicáveis. Os princípios das BPF da ISO 15378: 2017 na produção e controle de materiais de embalagem primários são importantes para a segurança de um paciente que recebe o medicamento devido ao contato direto entre os materiais de embalagem e o produto.
A ISO 15378: 2017 segue a estrutura da Diretiva ISO / IEC Parte 1 do Anexo L (anteriormente chamado de Anexo SL). O anexo estipula como os MSSs da Organização Internacional para Padronização (ISO) devem ser redigidos. O objetivo do Anexo L é fornecer alinhamento e consistência dos MSSs, fornecendo uma estrutura de alto nível para texto central comum, termos comuns e definições essenciais.
De acordo com a ISO, a estrutura do Anexo L:
- Coloque maior ênfase no envolvimento da liderança
- Ajude a abordar riscos e oportunidades organizacionais de maneira estruturada
- Abordar o gerenciamento da cadeia de suprimentos com mais eficiência
- Seja mais amigável para organizações de serviço e baseadas no conhecimento
- Use uma linguagem simplificada e uma estrutura e termos comuns, que sejam particularmente úteis para organizações que usam vários sistemas de gerenciamento, como sistemas de ambiente, saúde e segurança ou continuidade de negócios
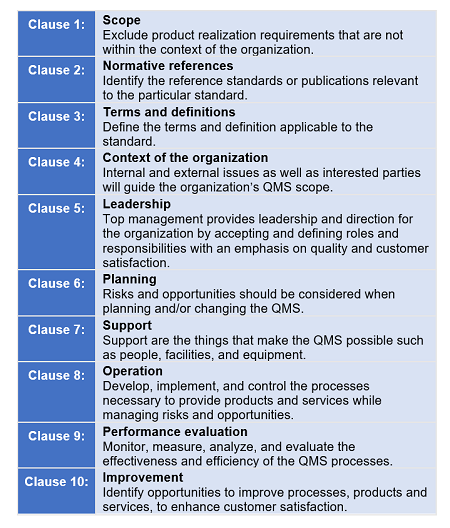
Figura 2: Estrutura de alto nível do anexo L
A ISO 15378: 2017 especifica os requisitos de BPF aplicáveis aos materiais de embalagem primários para um sistema de gerenciamento de qualidade em que uma organização precisa demonstrar sua capacidade de fornecer materiais de embalagem primários para medicamentos que atendem consistentemente aos requisitos regulamentares e do cliente. A ISO 15378: 2017 se aplica a todo o ciclo de vida da embalagem primária de medicamentos, incluindo design, produção, controle de qualidade, rotulagem, manuseio, armazenamento e distribuição.
Princípios Básicos de BPF
Os princípios básicos das BPF são semelhantes aos exigidos em 21 CFR 210/211, 820 e 1270/1271. As diretrizes GMP não são instruções prescritivas sobre como projetar, fabricar, rotular, armazenar e distribuir produtos. As diretrizes GMP são princípios gerais que devem ser aplicados. O SGQ deve garantir que os processos sejam controlados. Cada empresa é responsável por determinar os métodos mais eficazes e eficientes para garantir a conformidade com as diretrizes de BPF e os princípios gerais.
Os requisitos da norma ISO 15378: 2017 GMP aplicáveis a materiais de embalagem primária incluem:
- O design, produção, controle de qualidade, rotulagem, manuseio, armazenamento e distribuição de materiais de embalagem primários devem minimizar qualquer risco à sua qualidade.
- As instalações de fabricação, teste e armazenamento devem ser limpas e higiênicas.
- O projeto da instalação, os princípios operacionais e as condições ambientais devem ser controlados para evitar a contaminação e a contaminação cruzada dos materiais de embalagem primários.
- Os processos de fabricação devem ser claramente definidos, validados e controlados para garantir consistência e conformidade com as especificações. Quaisquer alterações no processo devem ser avaliadas da perspectiva da segurança do paciente e da qualidade do produto, e qualquer alteração aprovada que possa afetar a qualidade dos materiais primários da embalagem deve ser qualificada ou validada conforme necessário.
- Os procedimentos operacionais padrão (POPs) e as instruções de trabalho (WIs) devem ser escritos em linguagem clara e inequívoca, usando boas práticas de documentação (GDPs).
- Os operadores devem ser treinados para realizar a produção e o controle de qualidade dos materiais de embalagem primários, de acordo com os POPs e WIs documentados e aprovados.
- Registros das atividades de fabricação e controle de qualidade são necessários para demonstrar que todas as etapas necessárias exigidas pelos POPs e WIs foram executadas adequadamente e que os atributos de qualidade especificados dos principais materiais de embalagem foram atendidos. Todos os desvios devem ser investigados e documentados.
- O processo deve permanecer em um estado de controle durante todo o ciclo de vida do produto e as melhorias feitas conforme necessário.
- Os registros de fabricação, rotulagem, teste e distribuição devem ser mantidos e acessíveis em um formato que possa rastrear o histórico completo de um lote.
- Um sistema deve estar disponível para recuperar qualquer lote do armazenamento e / ou distribuição.
- As reclamações devem ser avaliadas, as causas dos defeitos de qualidade investigadas e as medidas apropriadas tomadas com relação aos produtos defeituosos e para evitar a recorrência.
A ISO 15378: 2017 fornece dois anexos normativos muito úteis:
- Requisitos CMP (normativos) do Anexo C para materiais de embalagem primária impressos
- Anexo D (informativo) Diretrizes sobre requisitos de verificação, qualificação e validação
para materiais de embalagem primária
Embalagem e risco
Em toda a ISO 15378: 2017, o termo “avaliação de risco” é referenciado 22 vezes. A ISO 15378: 2017 requer avaliações de risco para determinar o nível de risco e a resposta da organização a esses riscos. Existem várias ferramentas comumente usadas para realizar uma avaliação de risco, incluindo análise de efeito de modo de falha (FMEA), análise de árvore de falha (TLC), ponto de controle crítico de análise de risco (HACCP) e análise de risco e controles preventivos baseados em risco (HARPC) . O FMEA e o FTA se concentram nos riscos do processamento, enquanto o HACCP e o HARPC se concentram principalmente nos riscos de riscos intencionais e não intencionais de contaminação física, biológica, química e radiológica.
Outros fatores que devem ser considerados ao avaliar os riscos dos materiais de embalagem primários são atos de terrorismo e outros eventos nefastos, como produtos ilegais, falsificados, intencionalmente contaminados e / ou falsificados.
Conclusão
Sem GMPs, a qualidade dos materiais de embalagem primária pode não ser garantida, levando a possíveis problemas de qualidade, reclamações de clientes e ações regulatórias. É essencial que você confirme que seu fornecedor de materiais de embalagem primários para medicamentos estabeleceu, implementou e mantém um SGQ adequado e também considera os requisitos adicionais de BPF da ISO 15378: 2017 para garantir que os materiais de embalagem sejam adequados para o uso pretendido.
Referências:
- Diretivas ISO / IEC Parte 1 15a Ed., Organização Internacional de Normalização (ISO), maio de 2019.
- Sistemas de gestão da qualidade ISO 9001: 2015 - Requisitos.
- ISO 15378: 2017 Materiais primários de embalagem de medicamentos - Requisitos particulares para a aplicação da ISO 9001: 2015 , com referência às boas práticas de fabricação (BPF).
Sobre o autor:
 Mark Allen Durivage trabalhou como médico, educador, consultor e autor. Ele está gerenciando o consultor principal da Quality Systems Compliance LLC, um membro da ASQ e um membro da SRE. Ele obteve um BAS em usinagem assistida por computador pela Universidade de Siena Heights e um mestrado em gerenciamento de qualidade pela Eastern Michigan University. Ele possui várias certificações, incluindo CRE, CQE, CQA, CSQP, CSSBB, RAC (Global) e CTBS. Ele escreveu vários livros disponíveis na ASQ Quality Press, publicou artigos no Quality Progress e é colaborador frequente do Life Science Connect. Durivage reside em Lambertville, Michigan. Não hesite em enviar um e-mail para mark.durivage@qscompliance.com ou conectar-se a ele no LinkedIn .
Mark Allen Durivage trabalhou como médico, educador, consultor e autor. Ele está gerenciando o consultor principal da Quality Systems Compliance LLC, um membro da ASQ e um membro da SRE. Ele obteve um BAS em usinagem assistida por computador pela Universidade de Siena Heights e um mestrado em gerenciamento de qualidade pela Eastern Michigan University. Ele possui várias certificações, incluindo CRE, CQE, CQA, CSQP, CSSBB, RAC (Global) e CTBS. Ele escreveu vários livros disponíveis na ASQ Quality Press, publicou artigos no Quality Progress e é colaborador frequente do Life Science Connect. Durivage reside em Lambertville, Michigan. Não hesite em enviar um e-mail para mark.durivage@qscompliance.com ou conectar-se a ele no LinkedIn .
Nenhum comentário:
Postar um comentário