Melhores práticas para pré-formulação no desenvolvimento de medicamentos
Por Andrei Blasko, em nome da AAPS

Os testes de pré-formulação abrangem todos os estudos realizados em um novo composto medicamentoso, a fim de produzir informações úteis para a formulação subsequente de uma forma farmacêutica estável e biofarmaceuticamente adequada. 1 A pré-formulação é a conexão entre a descoberta e a entrega de medicamentos. Devido à rivalidade científica entre a descoberta e o desenvolvimento de medicamentos, o grupo de pré-formulação desempenha o papel de negociador de paz. Em algumas empresas, a linha entre a pré-formulação e a formulação é uma zona cinzenta; mantê-los separados leva a grandes recompensas.
Existem vários estágios para estudos de pré-formulação durante o desenvolvimento: pré-formulação para seleção de medicamentos candidatos em química medicinal (MedChem) ou estágio de descoberta de medicamentos, pré-formulação em desenvolvimento inicial e pré-formulação em desenvolvimento tardio (principalmente para caracterização extensa, como todos os polimorfos possíveis).
A via de administração determina o que é importante na pré-formulação. Idealmente, para uma forma de dosagem sólida oral, prefere-se para desenvolvimento um composto polimorfo estável, solúvel em água, não higroscópico e facilmente processável. Para compostos sólidos para inalação, o API precisa ser micronizado ou seco por pulverização. A micronização é um processo que consome muita energia que pode alterar a cristalinidade e gerar conteúdo amorfo e, assim, a interação subsequente com a umidade pode ser importante para a estabilidade. Para uma formulação de solução, incluindo produtos para inalação parentérica e nebulizada, a estabilidade do composto em solução será primordial.
Por que fazer estudos de pré-formulação para seleção de medicamentos?
É útil realizar estudos de pré-formulação e estudos biofarmacêuticos na fase de seleção de medicamentos candidatos para determinar as propriedades físico-químicas e biofarmacêuticas mais relevantes de potenciais medicamentos candidatos para auxiliar na seleção de candidatos. O objectivo é conseguir uma transição perfeita da investigação para o desenvolvimento, em oposição à abordagem tradicional “over-the-wall” que muitas empresas farmacêuticas experimentam, o que aumenta os seus custos. A seleção do candidato começa na identificação do líder da química medicinal (somente polimorfo), na otimização e pré-nomeação do líder (três principais líderes), seguida pela decisão sobre o API, o sal e o polimorfo (para sólidos), muitas vezes referido como perfil farmacêutico. É importante observar as responsabilidades estruturais do medicamento candidato, pois elas podem prever a estabilidade a longo prazo do API no medicamento. Um físico-químico orgânico pode prever se o candidato terá problemas de estabilidade e, portanto, terá menos probabilidade de chegar ao mercado. O processo de seleção de candidatos precisa de dados sobre constante(s) de acidez (pK a ), coeficientes de partição e distribuição (logP, logD), solubilidade, estabilidade da solução e caracterização do estado sólido: cristalinidade, higroscopicidade, estabilidade do estado sólido, seleção de sal, e triagem precoce de polimorfos.
Pré-formulação no desenvolvimento inicial
Da fase MedChem já existem dados disponíveis sobre o API: 1 H/ 13 C/2D-NMR, espectro de massa de alta resolução/alta precisão, análise elementar, HPLC, IR/UV-vis, algumas informações de solubilidade/estabilidade, e higroscopicidade que precisa ser compartilhada com o grupo de desenvolvimento.
1. Solubilidade
Solubilidade aparente e solubilidade de equilíbrio. O estado físico do soluto em equilíbrio com a solução é um fator chave na determinação de sua solubilidade. Como o soluto pode deixar de existir no seu estado físico original uma vez equilibrado, o estado físico não pode ter qualquer efeito na sua solubilidade de equilíbrio. As modificações no cristal podem produzir um aumento na taxa de dissolução e um aumento temporário ou aparente na solubilidade (solubilidade cinética). O efeito da estrutura cristalina na solubilidade dura apenas se o sólido modificado estiver em equilíbrio com a solução. Com tempo suficiente, ele reverterá para a forma cristalina mais estável (solubilidade termodinâmica).
Solubilidade aparente e tamanho de partícula. A relação entre o raio de uma partícula esférica e sua solubilidade é dada pela equação de Kelvin. A equação de Kelvin prevê que as partículas crescem com o tempo. A moagem de bolas produz um aumento na solubilidade aparente. A secagem por pulverização e a liofilização podem ser usadas para produzir pequenas partículas e podem aumentar a solubilidade aparente.
Perfil de solubilidade de pH de ácidos e bases fracas (Figura 1). Os ácidos fracos solubilizados (AH) são imagens espelhadas de bases fracas (B) e são a soma das espécies ionizadas e não sindicalizadas. A expressão da constante de dissociação K a leva às equações de Henderson-Hasselbalch e de solubilidade.
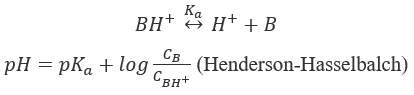
que fornecem a equação de solubilidade para um ácido fraco,
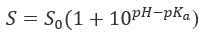
e uma base fraca,
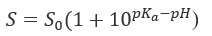
onde S 0 é a solubilidade intrínseca (solubilidade das espécies sindicalizadas).
Você pode determinar a solubilidade dos sais a partir do pH max , sem primeiro criar os sais. 2

Figura 1 : Perfil de solubilidade de pH de uma base fraca
Efeito de íon comum. Se um íon em comum com o eletrólito fraco for adicionado à solução, o equilíbrio é alterado (momentaneamente). Para restabelecer o equilíbrio, parte do sal da solução precipitará. A adição de um íon comum reduz a solubilidade de um eletrólito pouco solúvel (importante para a estabilidade de suspensões sólidas); a exceção é quando o íon comum forma um complexo com o sal. Os sais que não têm nenhum íon em comum com o eletrólito ligeiramente solúvel produzem um efeito oposto ao de um íon comum: em concentrações moderadas, eles aumentam em vez de diminuir a solubilidade porque diminuem o coeficiente de atividade, mas não dramaticamente.
2. Cinética de reação
A cinética da reação (química) é o estudo das taxas de processos químicos e inclui investigações de como diferentes condições experimentais podem influenciar a velocidade de uma reação química e fornecer informações sobre a forma como o composto se degrada. Existem algumas questões que precisam ser abordadas. Por exemplo, como a cinética da reação é útil no desenvolvimento de medicamentos; isso é muito acadêmico? Se você for muito fundo, isso pode se tornar acadêmico; no entanto, você precisa obter as respostas necessárias para o seu objetivo, ou seja , a estabilização do seu medicamento. Para estabilizar um medicamento, precisamos saber como o API se degrada e o que é necessário para que uma reação ocorra: colisão (requer mobilidade; solução vs. estado sólido), orientação/proximidade e energia de ativação (por exemplo, calor) . Para obter as respostas, os cientistas farmacêuticos realizam degradação forçada. A primeira utilização dos estudos de degradação forçada é para o desenvolvimento de métodos analíticos. Há um ditado que diz que a descoberta começa com medições. Quanto melhores forem as medições, mais confiáveis serão os dados e o processo de decisão. Portanto, não economize na degradação forçada.
Outra questão é por que precisamos conhecer o perfil da taxa de pH e por que precisamos de pHs extremos como pH 1 e pH 13? Uma das principais vias de degradação de um composto farmacêutico é a hidrólise, e você encontrará diferentes barreiras de embalagem para proteção contra umidade para os medicamentos comercializados. Portanto, precisamos conhecer o pH de estabilidade máxima. Mas por que valores de pH cada vez mais baixos? A resposta é que seus dados ajudam no desenvolvimento analítico e podem fornecer feedback aos químicos de processos, onde pHs extremos são usados na preparação de amostras ou em operações unitárias. Além disso, um perfil de taxa de pH que cubra toda a faixa de pH pode definir melhor a estabilidade máxima ( ou seja , degradação mínima) e há vários casos em que o perfil é mais complexo (por exemplo, curva em forma de sino, Figura 2).

Figura 2: Perfil de taxa de pH do derivado de adrenalina CpQ 5
3. Mecanismo de reação
A sequência das reações elementares individuais é conhecida como mecanismo de reação. Uma reação elementar envolve algumas moléculas, geralmente uma ou duas. Mas por que precisamos conhecer o mecanismo de reação? Compreender como o API se degrada ajuda a projetar a formulação, auxilia na identificação de produtos de degradação e auxilia no desenvolvimento de métodos analíticos para alertas estruturais, onde é necessário ir para a quantificação em nível de ppm. Freqüentemente, a degradação de um composto não para na primeira etapa da reação, como no caso da oxidação. Contudo, a primeira etapa da reação é importante para a estabilidade de um medicamento. O mecanismo de reação pode ajudá-lo a determinar esta etapa; a cinética lhe dá uma resposta sobre o tempo.
A pré-formulação para produtos biológicos é diferente daquela para moléculas pequenas
Os produtos biológicos precisam ser fabricados, enviados, armazenados e entregues ao paciente, minimizando ao mesmo tempo sua degradação. Uma das vias de degradação mais preocupantes é a agregação, levando à imunogenicidade que pode ser desencadeada com potencial para causar efeitos adversos nos pacientes. Os métodos analíticos devem ser desenvolvidos e validados. Uma vez que haja confiança nos dados analíticos, você pode iniciar o desenvolvimento da formulação. Também é importante compreender como vários excipientes conseguem ou não estabilizar o API durante a fabricação e armazenamento.
As condições de estresse geralmente são mais amenas para produtos biológicos do que para moléculas pequenas. O primeiro uso da degradação forçada do API é para a estabilidade, indicando o desenvolvimento de métodos analíticos, uma ferramenta indispensável para a avaliação de diferentes formulações.
Existem três modos comuns de desnaturação e degradação: agregação, oxidação e desamidação. Dependendo da complexidade da biomolécula, outros tipos de degradação podem ocorrer: isomerização, fragmentação, mistura de dissulfeto, N- e O-glicosilação, clipagem (truncamento de lisina C-terminal) e formação de piroglutamato. Nota : A preparação da amostra pode levar à degradação.
O perfil da taxa de pH determina o pH de estabilidade máxima. As proteínas são mais estáveis em seu ponto isoelétrico (pI), mas o pK a dos aminoácidos e, portanto, o pI, muda com a força iônica; uma formulação carregada com espécies iônicas deve ser evitada e a concentração do tampão deve ser minimizada.
Degradação forçada. Na degradação forçada procuramos as principais vias de degradação: agregação, oxidação, desamidação e fotólise. A agregação é um dos tipos de degradação mais examinados para produtos biológicos porque os agregados podem induzir uma resposta imunogênica com consequências de segurança.
Compatibilidade medicamento-excipiente
O desempenho da forma farmacêutica final (biodisponibilidade e estabilidade) ou a capacidade de fabricação dependem dos excipientes, de sua concentração e de sua interação com o API e entre si. Os excipientes não podem mais ser considerados simplesmente ingredientes inertes ou inativos, conforme descrito no ICH Q8(R2) Pharmaceutical Development. É importante conhecer suas propriedades, requisitos de segurança e manuseio e aspectos regulatórios. Foi relatada uma lista de excipientes comumente usados na formulação de proteínas. 3 Só porque alguns destes excipientes foram aprovados pela FDA, não significa que possam ser usados indiscriminadamente (por exemplo, a glicose é um açúcar redutor). Além disso, a maioria das surpresas durante a estabilidade do medicamento vem dos excipientes, particularmente das impurezas nos excipientes.
Tampões/Sais . A primeira informação que você precisa saber sobre a degradação do API é o pH de máxima estabilidade, o que leva à seleção do tampão da formulação. A água não tem capacidade de resistir às mudanças de pH; O CO 2 do ar equilibrado com água altera o pH de 7 para 5,7. É importante saber que alguns buffers podem criar problemas. Os fosfatos são dependentes de Ca e os sais de Ca precipitam. Os citratos são quelantes, enquanto o Tris é um tampão reativo. Tampões como Histidina ou Bis-Tris precisam ser avaliados no pH de estabilidade máxima dentro de ±1 unidade de pH em incrementos de 0,5 pH. Escolha a concentração mais baixa possível (agregados formam-se em µ elevado).
Foi estabelecido nos últimos anos que o tampão não só mantém o pH apropriado da solução à qual a proteína é estável na sua estrutura nativa, como também pode influenciar a estabilidade da própria proteína. 4 Os tampões reconhecidos como estabilizadores de proteínas foram Tris, acetato, HEPES e cacodilato; entretanto, o Tris é um tampão reativo e deve ser evitado, a menos que haja dados suficientes que justifiquem seu uso.
Açúcares . Os açúcares são estabilizadores excepcionalmente bons de proteínas e são considerados co-solventes. A melhor escolha na formulação de proteínas são os açúcares não redutores, como sacarose e trealose. Contudo, a trealose cristaliza durante a liofilização; a sacarose permanece amorfa, mas a trealose tem uma temperatura de transição vítrea mais alta (T g ≈ 80 °C). O excepcional efeito de estabilização da trealose na estabilidade térmica das proteínas é atribuído ao efeito da tensão superficial.
Surfactantes . Quase todas as proteínas são adsorvidas até certo ponto em superfícies (vidro, plástico, metal) e tanto a fabricação quanto a análise laboratorial tiveram que lidar com esta propriedade. Além disso, as soluções proteicas na interface água/ar levam à agregação. Surfactantes não iônicos são comumente usados para evitar contribuição extra para as espécies iônicas (por exemplo, tampões) que podem induzir agregação ou precipitação.
Antioxidantes . Os antioxidantes ajudam a proteger contra a oxidação, eliminando o oxigênio para si próprios. O ácido ascórbico é comumente usado, mas o ácido cítrico é o preferido, pois também é um ajustador de pH. No entanto, alguns citratos (Fe 3+ ) causam descoloração. Considere como antioxidante uma molécula sacrificante como a metionina. A escolha do antioxidante é ditada pela probabilidade de oxidação do API.
Referências
- Akers, MJ Can. J. Farmacêutica. Ciência. 1976, 11, 1-10
- Mole, J., Box, K., Comer, J. AAPS 2010, https://assets-global.website-files.com/644d2ffb3f7ec1eca95b44dd/64f1891ca1681bab1fe5344c_Sirius-AAPS2010-Measuring-the-solubility-of-salts.pdf
- Capelle, MAH e outros. EUR. J. Parm. Biofarmacêutica. 2007, 65, 131
- Brudar, S.; Hribar-Lee, B. Biomoléculas 2019, 9, 65
- Blasko, A. e outros, Bioquímica 2018, 57 (30), 4536-4546, DOI:10.1021/acs.biochem.8b00462
Este artigo é baseado na gravação do prólogo AAPS PharmSci 360 do autor .
Sobre o autor:
Andrei Blasko é especialista na descoberta e desenvolvimento de novos medicamentos (moléculas pequenas e produtos biológicos: mAbs/Fabs, proteínas) com 25 anos de experiência na indústria farmacêutica. Depois de concluir dois pós-doutorado na Universidade da Califórnia em Santa Bárbara, Blasko trabalhou na Roche, Sugen/Pharmacia/Pfizer, Celera, Pain Therapeutics (Cassava Sciences Inc.) e Novartis.
Ele é membro da Royal Society of Chemistry (FRSC), editor-chefe do Journal of Applied Pharmacy , membro do conselho editorial do American Journal of Advanced Drug Delivery e foi consultor do FAST no California Life Sciences Institute. Após oito anos na Novartis, Blasko trabalhou como consultor independente de CMC e em 2021 fundou a Clearview Pharma Solutions, LLC. Ele detém sete patentes concedidas.
Nenhum comentário:
Postar um comentário