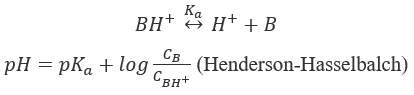Considerações para aliviar a aderência e a separação na fabricação de tablets
Por Bill Turner e Kevin Queensen
COMO EVITAR COLAR E ESCOLHER
A aderência ocorre quando os grânulos da formulação aderem à face do copo do perfurador. Picking refere-se à formulação colada nas letras e caracteres da gravação em relevo. Ambos resultam em defeitos do tablet e menor produção devido ao tempo gasto na solução de problemas. Problemas de aderência e separação são comuns na fabricação de comprimidos, seja em aplicações farmacêuticas, nutracêuticas ou de confeitaria. Esses problemas comuns normalmente surgem de inadequações na formulação ou no design do comprimido; eles podem contribuir para problemas de compactação. Ambos surgem devido às diferenças nas propriedades físicas dos excipientes da formulação e da substância medicamentosa. O processo de mistura dos componentes de uma formulação pode resultar em um pó que irá consolidar e comprimir ou não. Como a falha na compressão em um comprimido é uma questão separada, neste capítulo consideraremos apenas os pós que se comprimem.
No mundo regulamentado (e competitivo) da produção de medicamentos, pode haver um sentimento de urgência no desenvolvimento de uma nova molécula. Esta urgência pode resultar em decisões precipitadas para iniciar ensaios clínicos ou submeter para aprovação regulamentar uma formulação que apresenta problemas imprevistos de aumento de escala de compressão. E ainda assim, o processo de design de uma forma farmacêutica sólida oral muitas vezes ignora alguns dos detalhes aparentemente menores do design do comprimido. Defeitos nos comprimidos podem ocorrer à medida que a fabricação aumenta do fornecimento clínico para a população total de pacientes. Os desejos dos departamentos de marketing das empresas farmacêuticas por determinados formatos e logotipos de comprimidos para aumentar o reconhecimento da marca são uma fonte de restrições de design, muitas vezes resultando em complicações de fabricação pós-aprovação. Os fabricantes de ferramentas de compressão podem identificar possíveis problemas de travamento e separação antes que os projetos de pastilhas e ferramentas sejam finalizados, reduzindo o desafio compartilhado entre o fabricante da pastilha e o fornecedor de ferramentas.
FORÇAS COESIVAS: FORMANDO UM COMPRIMIDO DE DOSE SÓLIDA
A formação de um compacto é o resultado de forças químicas dispersivas e mecânicas que unem as partículas para formar um sólido de densidade e porosidade mensuráveis. As forças coesivas que ligam as partículas podem ser avaliadas através de uma série de estudos para determinar se os problemas com a compactação dos comprimidos podem ser antecipados. Perfis de compactação e estudos de taxa de deformação são importantes para projetos de desenvolvimento. Esses estudos garantem alta probabilidade de expansão e transferência técnica bem-sucedidas. Portanto, a oferta do mercado não é afetada porque a devida diligência técnica foi negligenciada.
As partículas do comprimido são ligadas por forças coesivas. Contudo, durante o processo de compressão, as forças coesivas que unem as partículas competem com as forças adesivas do copo do perfurador e, se presentes, com a gravação dentro do copo do perfurador. O primeiro estágio de um problema de aderência ocorre quando a força adesiva do copo perfurador puxa até mesmo uma única partícula para longe do comprimido. Uma publicação recente mostrou que isso é causado principalmente pelas propriedades físicas do ingrediente farmacêutico ativo (API), e o mecanismo e a cinética podem ser modelados com sucesso.
CONSIDERAÇÕES SIMPLES PARA ALIVIAR A COLAGEM E A ESCOLHA
Quando o pó gruda nas letras em relevo, uma das primeiras coisas a verificar é o nível de umidade da formulação. A correção de pegas e aderências nem sempre equivale à mudança das ferramentas usadas na fabricação de comprimidos. Uma força de compressão insuficiente também é uma fonte potencial de separação porque a compactação do pó não é completa. Isto significa que as forças adesivas podem facilmente superar as forças coesivas do comprimido inadequadamente comprimido.
A inspeção cuidadosa dos copos do punção também é essencial para garantir que não haja arranhões superficiais que possam capturar pequenas partículas da formulação. Arranhões podem causar película, uma forma lenta de aderência, muitas vezes devido ao excesso de umidade na granulação. Faça o polimento dos punções quando forem identificados riscos superficiais. Um composto de polimento especializado pode conferir maior lubricidade e melhores propriedades de liberação do produto. Também é importante notar que um acabamento espelhado no copo do perfurador pode não ser o acabamento superficial ideal para todos os produtos e comprimidos. Alguns estudos e testes mostraram que um acabamento fosco (também conhecido como bead blast) é benéfico para alguns produtos. Se possível, faça um teste com diversas opções de materiais, revestimentos e acabamentos. Às vezes, casos de teste mostraram que um acabamento fosco pode resolver problemas de aderência.
Outra solução potencial é aumentar ligeiramente a quantidade de lubrificante utilizado na formulação. Isto melhora as características de libertação do comprimido comprimido da superfície do copo do perfurador. Esteja ciente de que adicionar uma quantidade excessiva de lubrificante pode dificultar o processo de ligação das partículas, levando a uma situação de aderência mais grave.
Se essas soluções não resolverem seu problema de travamento, poderá ser necessária uma revisão completa do projeto do tablet e das ferramentas.
REDUZINDO A SELEÇÃO COM SELEÇÃO DE FONTE
A seleção de fontes costuma ser uma batalha entre forma e função. Uma fonte ornamentada ou decorativa, embora agradável à vista, pode causar problemas de seleção e defeitos na pastilha. A Figura 1 ilustra uma seleção de fonte impraticável. Em geral, a maioria das formulações de produtos devem ser facilmente comprimidas em comprimidos utilizando ferramentas com este desenho de gravação. Contudo, muitas formulações não são típicas e ainda podem ocorrer problemas. O conceito de pré-seleção parcial aplica-se a qualquer letra ou número com áreas totalmente fechadas (“ilhas” ou “blocos”). Muitos personagens um tanto complexos sem áreas totalmente fechadas também são propensos a serem escolhidos. Letras como E, S, K e M e números como 2, 3 e 5 contêm áreas parcialmente fechadas descritas como penínsulas.
A variação na largura da gravação, bem como as penínsulas isoladas e desnecessárias das letras, são impeditivos para uma compactação uniforme do pó. Esta variação muitas vezes faz com que o pó se solte do núcleo comprimido do comprimido e permaneça no copo do perfurador. A Figura 2 ilustra o mesmo relevo usando uma fonte prática que utiliza uma largura de gravação consistente e raios de canto e de gravação aumentados. A modificação da fonte minimiza as oportunidades de coleta, aumenta a oportunidade de compactação consistente do pó e produz as melhores forças coesivas possíveis para o comprimido.


ALTERANDO O CORTE DA GRAVAÇÃO
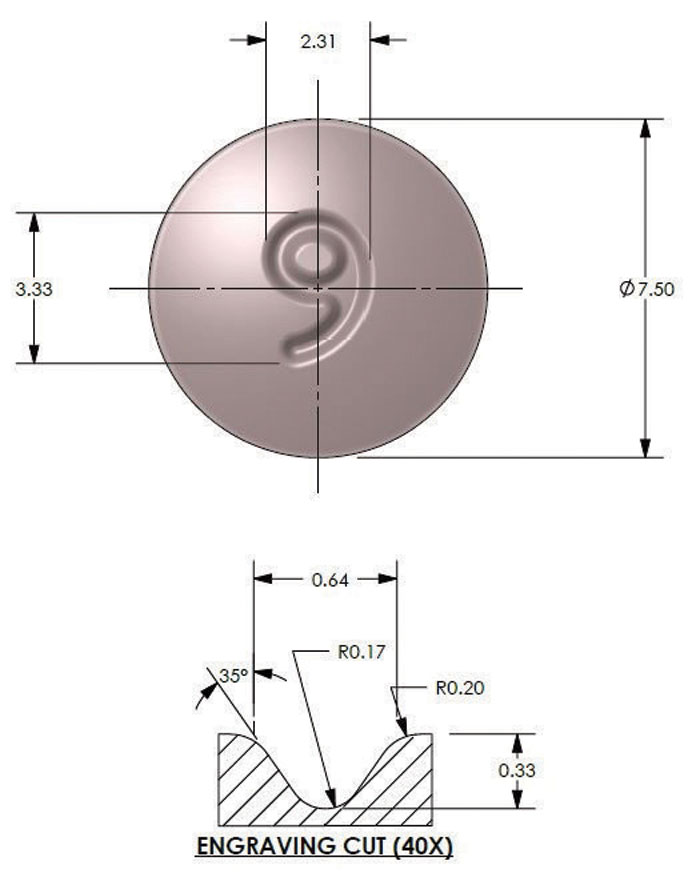
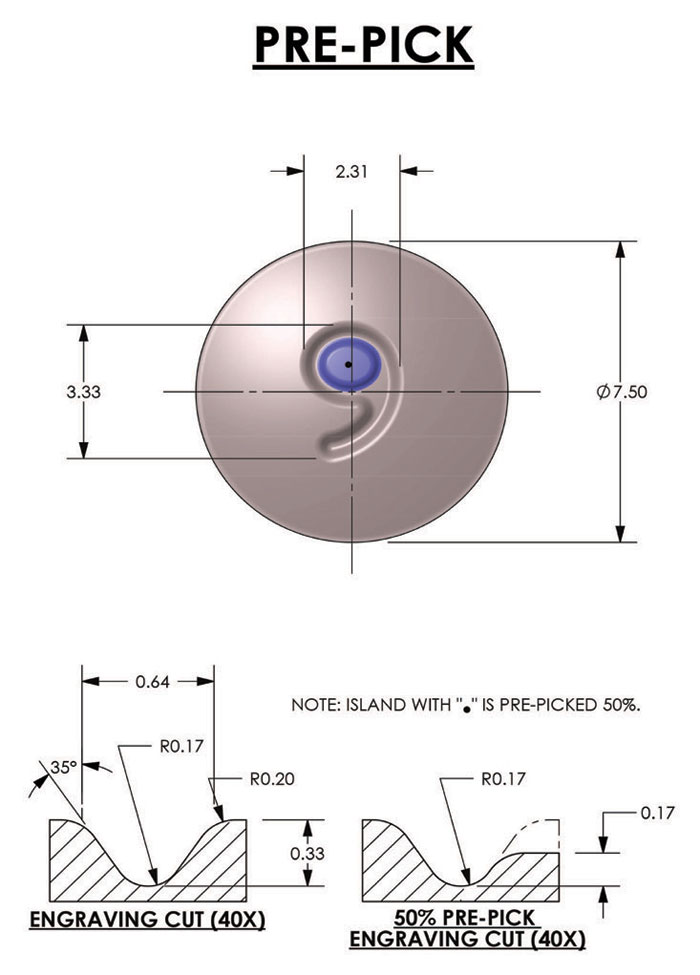
Além de alterações na seleção da fonte, preste atenção especial ao desenho do próprio corte da gravura. A Figura 3 ilustra um comprimido redondo típico. A gravação do “9” é cortada no tablet com uma largura de corte de gravação comum, profundidade e ângulo de 35 graus. Para reduzir ou eliminar problemas com a coleta de materiais na ilha central do “9”, a pré-coleta, parcial ou completa, pode ser incorporada no projeto. A Figura 4 ilustra onde a profundidade da ilha é reduzida de 0,33 mm para 0,17 mm. Esta redução é definida como uma pré-seleção parcial de 50%. O valor da redução pode variar entre 10 e 100%, sendo 100% a remoção completa da ilha. Para fins estéticos ou de marca, deve-se levar em consideração os comprimidos revestidos pós-compressão, pois a pré-escolha excessiva pode reduzir significativamente a clareza do logotipo.
Evite a colheita nessas áreas afunilando ou aumentando. Começando na superfície da pastilha na extremidade aberta da península, esse recurso diminui em direção à extremidade fechada da península em uma porcentagem da profundidade da gravação. As penínsulas normalmente diminuem entre 10 e 50 por cento da profundidade de gravação, sendo 30 por cento a mais comum. Uma conicidade de 50% da península “9” é ilustrada no canto inferior direito da Figura 5.
MATERIAIS DE CONSTRUÇÃO DE FERRAMENTAS
Punções feitas de aço especial são uma opção a ser considerada quando a aderência é um problema, seja um problema contínuo ou descoberto durante o estágio de pesquisa e desenvolvimento. É amplamente aceito que o aço perfurado com alta concentração de cromo na química da liga, geralmente entre 16 e 18%, aumenta a liberação do produto comprimido. Um fornecedor de ferramentas respeitável oferecerá vários tipos de aço com alto teor de cromo. Além disso, vários outros aços especiais estão disponíveis para melhorar o desempenho e a vida útil dos punções e matrizes em relação à resistência à compressão, resistência ao desgaste e resistência à corrosão.
Considere também a aplicação de revestimento em seus punções de aço padrão como uma alternativa para melhorar as características de liberação das faces do punção. Os revestimentos mais comuns são cromo duro (Cr) e nitreto de cromo (CrN). Vários outros revestimentos também estão disponíveis, incluindo nitreto de zircônio (ZrN), dependendo das características exclusivas da mistura a ser comprimida. No entanto, a fina camada de revestimento de cromo pode desgastar-se com o tempo devido à abrasão da formulação e ao polimento. Assim, um aço com alto teor de cromo sem revestimento pode ser uma solução melhor a longo prazo.
Discuta essas questões com seu fornecedor de ferramentas no início do processo para ajudar a reduzir problemas de produção e custos adicionais. Seu fornecedor de ferramentas deve ser capaz de explicar as propriedades e vantagens exclusivas dos diversos aços e revestimentos.

PARA CONCLUIR
Existem vários meios para acelerar a chegada de um novo medicamento ao mercado, desde pequenas alterações na formulação até grandes modificações no design do comprimido e nas ferramentas. Ajude a eliminar aderências e rupturas antes que elas ocorram, discutindo com seu fornecedor de ferramentas todas as propriedades físicas exclusivas durante a fase de design do tablet. Seus insights no design de tablets e na resolução de possíveis problemas de aderência e separação beneficiarão o produto final e ajudarão a criar um tablet que seja aceito tanto pelo fabricante quanto pelo consumidor.