A Quality by Design (QbD) é uma abordagem sistemática para o desenvolvimento de produtos que começa com objetivos predefinidos e enfatiza a compreensão e os controles de produtos e processos com base em sólida ciência e gerenciamento de riscos de qualidade (ICH Q8). A ênfase do QbD começou com o reconhecimento de que o aumento dos testes não melhora essencialmente a qualidade do produto; no entanto, a qualidade deve ser incorporada ao produto. As agências reguladoras encorajam abordagens baseadas em risco e a adoção dos princípios de QbD no desenvolvimento e fabricação de medicamentos. Na Piramal, estamos aplicando uma abordagem de QbD no desenvolvimento de produtos, que é caracterizada pelos seguintes princípios:
- Projetando o produto e seu processo de fabricação para atender às necessidades do paciente em relação à segurança e eficácia
- Projetando processos de fabricação para produzir consistentemente produtos que preencham critérios de qualidade pré-definidos
- Compreender o impacto dos parâmetros de entrada na qualidade do produto para construir adequadamente os controles nos pontos críticos do processo
O QbD é principalmente um esquema científico, lógico e preventivo que incorporará o controle de qualidade em cada etapa do desenvolvimento de medicamentos e do processo de fabricação. Trata-se de uma abordagem orientada para os objetivos, na qual definimos o QTPP (Quality Target Product Profile - Perfil do Produto Alvo de Qualidade) nos estágios iniciais do desenvolvimento do produto. O QTPP descreve o desempenho desejado com base nos aspectos clínicos pretendidos, força da dosagem, modo de entrega, farmacocinética, critérios de qualidade do medicamento e sistema de fechamento do recipiente. O próximo passo é a identificação dos principais elementos do QbD da seguinte forma:
- Atributos Críticos de Qualidade (CQA) : Um CQA é uma característica física, química, biológica ou microbiológica de um medicamento de saída que deve estar dentro de um limite apropriado para garantir a qualidade desejada do produto. Os atributos de qualidade de um medicamento podem incluir identidade, ensaio, uniformidade de conteúdo, produtos de degradação, solventes residuais, liberação de fármaco, teor de umidade, limites microbianos e atributos físicos como cor, forma, tamanho, odor, configuração do escore e friabilidade. Esses atributos podem ser críticos ou não críticos. A criticidade de um atributo é baseada principalmente em sua influência na segurança e eficácia do paciente.
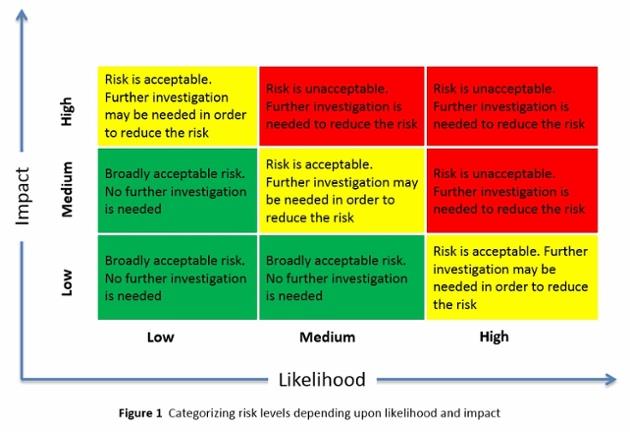
- Avaliação de risco: Existem muitos atributos do fármaco e dos excipientes que poderiam potencialmente impactar os CQAs dos intermediários e produto acabado. É impraticável para o cientista de formulação investigar todos os atributos de materiais e parâmetros de processo identificados durante os estudos de otimização de formulação. Portanto, uma avaliação de risco seria valiosa na identificação de atributos de materiais e parâmetros de processo que são críticos. A avaliação deve basear-se no conhecimento científico e na experiência do cientista de formulação. Os atributos de material e processo são considerados críticos quando uma alteração nesse atributo pode ter um impacto significativo na qualidade (CQA) do material de saída.Figura 1 ). Considerando 3 níveis diferentes (alto, médio e baixo), a decisão sobre a ação / investigação necessária para mitigar esse risco será considerada.
- Atributos críticos de material (CMA) : Um CMA de uma substância medicamentosa, excipiente e materiais em processo é uma característica física, química, biológica ou microbiológica de um material de entrada que deve estar consistentemente dentro de um limite apropriado para garantir a qualidade desejada de substância medicamentosa, excipiente ou material em processo. É provável que o CMA tenha um impacto no CQA do medicamento.
- Parâmetros Críticos do Processo (CPP): Os CPPs de um processo de manufatura são os parâmetros que, quando alterados, podem impactar potencialmente o produto CQA e podem resultar em falhas no cumprimento do limite do CQA.
- Espaço de projeto: De acordo com o ICH Q8, essa é a combinação multidimensional e a interação de variáveis de entrada (por exemplo, atributos de materiais) e parâmetros de processo que demonstraram fornecer garantia de qualidade. Um espaço de design pode ser construído para uma única operação unitária ou para todo o processo. O espaço de design pode ser o resultado direto da análise dos dados de DoE ou outros modelos validados. Trabalhar dentro do espaço de design não é considerado uma mudança. O movimento fora do espaço do projeto é considerado uma mudança e normalmente iniciaria um processo de mudança pós-aprovação regulamentar. O espaço de design é proposto pelo candidato e está sujeito a avaliação e aprovação regulatória.
- Estratégia de Controle: Com base no entendimento do processo e do produto, durante o desenvolvimento do produto, são identificadas fontes de variabilidade. Compreender as fontes de variabilidade e seu impacto nos processos, nos materiais em processo e na qualidade dos medicamentos pode permitir controles apropriados para garantir a qualidade consistente do medicamento durante o ciclo de vida do produto.
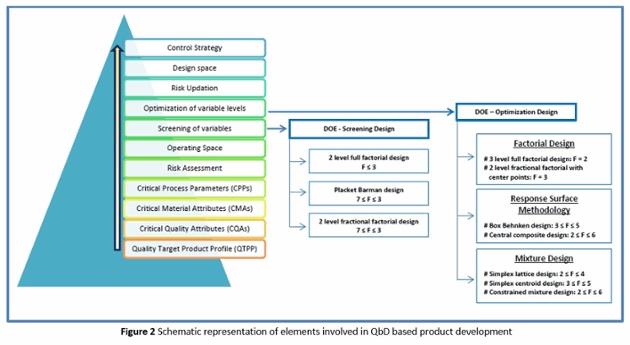
A representação esquemática da abordagem QbD no desenvolvimento de produtos é dada na Figura 2.
Ferramentas Aplicadas na Abordagem QbD
- Design of Experiment (DoE): Esta é uma abordagem sistemática aplicada para conduzir experimentos para obter o máximo de saída. Temos a capacidade e o conhecimento para executar o DoE no desenvolvimento de produtos usando softwares como Minitab e Statistica.
- Projeto de Experimentos - Triagem: Projetos aplicados para rastrear um grande número de fatores em um número mínimo de experimentos para identificar os significativos. O principal objetivo desses projetos é identificar os principais efeitos e não os efeitos de interação. Para tais estudos, os projetos comuns utilizados são Plackett-Burman e planejamento fatorial fracionário .
- Projeto de Experimentos - Otimização: Os projetos experimentais considerados para realizar a otimização são principalmente projeto fatorial completo, metodologia de resposta de superfície (por exemplo, composto central, Box-Behnken) e projetos de mistura. Esses projetos incluem efeitos e interações principais e também podem ter termos quadráticos e cúbicos necessários para obter curvatura. Esses projetos são aplicados apenas quando fatores selecionados são identificados, o que parece estar contribuindo para o processo ou formulação.
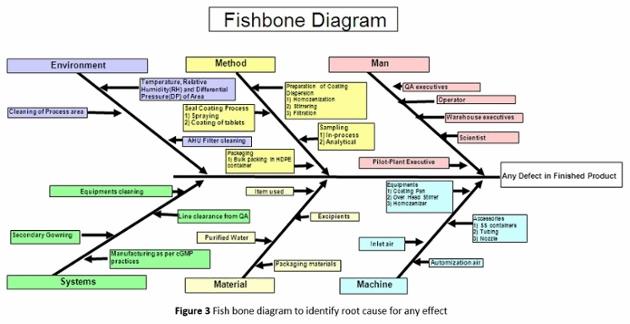
- Diagramas de Causa e Efeito (espinha de peixe / Ishikawa): Esta é uma metodologia muito básica para identificar múltiplos fatores possíveis para um único efeito ( Figura 3 ). Várias causas associadas a um único identificam a causa raiz. O ramo primário representa o efeito, enquanto os principais braches no diagrama estão associados a causas principais e os ramos menores suportam a possível causa detalhada.
- Análise do efeito do modo de falha (FMEA) : Esta é uma ferramenta importante para avaliar os modos de falha em potencial em qualquer processo. A quantificação do risco pela interação de funções probabilísticas de gravidade, ocorrência e detectabilidade de qualquer evento pode ser feita. O FMEA pode ser efetivamente executado com bom entendimento do processo.
- PAT- Estratégia de Controle: A garantia da qualidade do produto durante etapas intermitentes usando a tecnologia analítica de processo (PAT) é recomendada pelas autoridades reguladoras, que ainda não foi amplamente aceita pela indústria farmacêutica em detrimento de metodologias conservadoras. Envolve sistemas avançados de monitoramento on-line, como NIR (Near IR), espectrômetro Raman portátil, analisador de tamanho de partículas, etc. Temos experiência na aplicação de espectrômetros NIR e Raman para monitorar processos, a saber. mistura e granulação húmida. Essas tecnologias garantem ainda melhoria contínua na qualidade do processo e do produto ao longo do ciclo de vida.
Para resumir, o objetivo da implementação da QbD farmacêutica é reduzir a variabilidade e os defeitos no produto, aumentando assim a eficiência no desenvolvimento e fabricação do produto. Isso pode ser alcançado através da concepção de uma formulação robusta e processo de fabricação e estabelecendo especificações clinicamente relevantes. Os elementos-chave do QbD farmacêutico podem incluir o QTPP, a compreensão do design do produto e do processo, o aumento de escala, a estratégia de controle e a melhoria contínua. O conhecimento prévio de várias ferramentas, avaliação de riscos, DoE e PAT é valioso para facilitar a implementação do QbD.

Nenhum comentário:
Postar um comentário