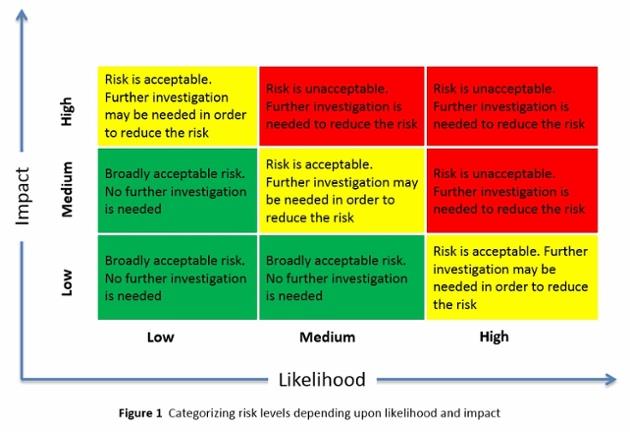
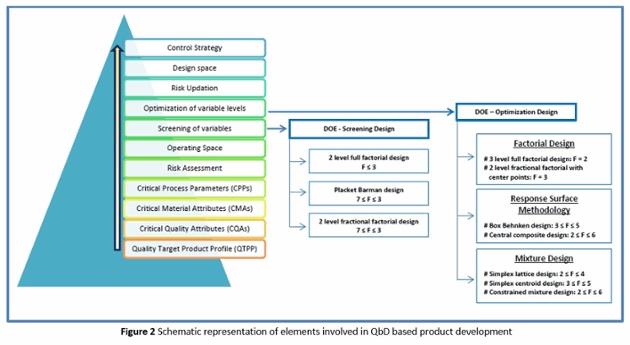
Detecção Precoce dos Desafios da Fluidez de Pó na Formulação do Desenvolvimento de Formas de Dosagem Sólidas
Fonte: Micromeritics Instrument Corporation
O fluxo de pó é uma métrica chave para o projeto do processo de fabricação farmacêutica. Entender o impacto do comportamento do pó durante a pré-formulação garantirá produtos clinicamente eficazes e fornecerá conhecimento crítico do processo para projetar um procedimento de fabricação eficiente e reproduzível. Ativos extremamente potentes e caros incorporados em pequenos volumes representam uma preocupação particularmente desafiadora durante as formulações e suas características devem ser compreendidas antes da transferência para a operação de fabricação. A segregação de misturas em pó e a interrupção do fluxo quando um pó é transferido para uma prensa de comprimidos é um problema crucial em operações de compressão direta.
As misturas de pó seco devem fluir uniformemente nos moldes do comprimido para obter um peso, dureza e uniformidade de conteúdo consistentes. Por conseguinte, é muito desejável compreender as propriedades de fluxo de excipientes de formulação de comprimido e cápsula, compostos ativos e misturas de formulação no início do desenvolvimento e estabelecer uma detecção precoce confiável de possíveis variáveis que podem impedir processos de fabricação robustos que fornecerão desempenho de produto em especificação.
Nos processos de manuseio de pó, a parada de fluxo é uma fonte comum de tempo de inatividade, retrabalho e desperdício de produto. Arcos e buracos são causados pela resistência do pó que excede a tensão causada pelas propriedades mecânicas e geométricas da tremonha. Estes podem se formar devido à alta fricção na parede e à tendência dos funis de baixo ângulo de causar “fluxo de funil”, quando o produto próximo às paredes não flui até que o material do centro tenha sido removido. Com o conhecimento adequado da resistência do volume do pó e das tensões causadas pelos parâmetros do equipamento de processo, esses atrasos dispendiosos podem ser detectados nos estágios iniciais do desenvolvimento da formulação, depois mitigados ou eliminados com o uso de materiais de excipiente e equipamento de processo apropriado.
Existem vários aparelhos e metodologias disponíveis para medir a resistência do material a granel. A maioria dos métodos envolve colocar um grande volume de amostra de material em uma célula de teste, adicionando tensão de compactação, girando (ou cortando) o aparato para obter fluxo constante, reduzindo a tensão principal e cortando novamente até que o material falhe. Vários testes são necessários para obter um ponto de dados da função de fluxo.
Um único ponto de dados UYS consiste em duas variáveis: a variável independente, pressão de consolidação, é uma medida da força de compressão aplicada a um material em um estado confinado; a variável dependente, a força de rendimento é a quantidade de pressão aplicada a um material em um estado não confinado no momento em que a falha ocorre e o fluxo começa. Com várias medições UYS, um engenheiro de processo pode caracterizar o conjunto de dados criando uma função de fluxo. Na maioria dos casos, o UYS aumenta com a pressão de consolidação. Uma função de fluxo pode ser ainda mais generalizada reduzindo os dados a um fator de vazão, a razão da força de consolidação para o UYS medido.
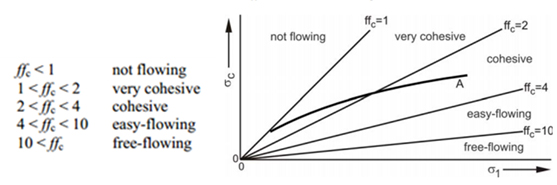
O SSSpinTester Powder Strength Analyzer da Material Flow Solutions utiliza uma nova abordagem de força centrípeta. Este princípio permite que a fluidez do pó seja coletada mais rapidamente, com mais precisão, usando apenas uma fração da quantidade de material requerida pelos instrumentos tradicionais de célula de cisalhamento.
A simplicidade do SSSpinTester oferece testes de resistência do material nas pressões de consolidação abaixo dos limites práticos dos sistemas de teste de cisalhamento. Uma centrífuga é usada para consolidar repetidamente 0.1cc de material. As portas de retenção da amostra são removidas e a célula da amostra é novamente acelerada até que o UYS seja atingido e a falha do material seja detectada. A forma cônica da célula de teste aplica essa força às bordas externas da amostra, de modo que a resistência do material, como um arco, esteja mantendo a amostra no lugar. UYS é determinado em 5 minutos, uma análise única. Uma função de fluxo total de 10 pontos pode ser coletada em menos de uma hora.
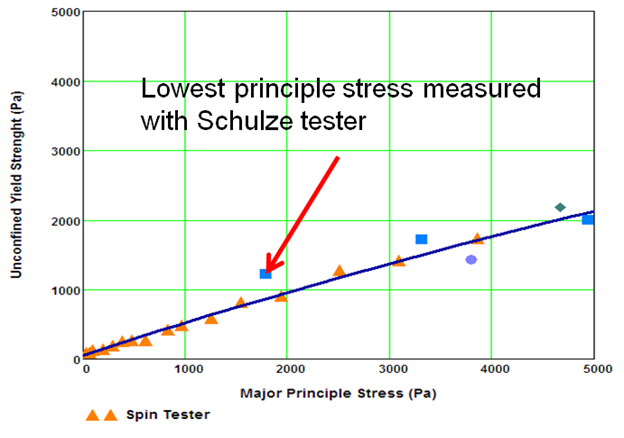
Exigindo apenas 0.1cc de material para executar um teste, o SSSpinTester é a única unidade de teste que pode medir a resistência do material durante a pré-formulação. Este é um investimento QbD fiscalmente importante e prudente, considerando o alto custo dos APIs usados em muitas formulações. Os testadores de força atuais exigem várias execuções de teste para uma única medição, com cada execução exigindo de 10 a várias centenas de gramas de material sendo necessário para o teste.
O SSSpinTester é um instrumento de teste inovador, único e eficiente para a resistência do pó para uso no desenvolvimento de formulações de formas sólidas de dosagem na indústria farmacêutica.