Selo de enchimento para produtos biológicos: rompendo o teto de vidro de embalagens farmacêuticas
Fonte: Weiler Engineering, Inc.
Por Bill Hartzel, diretor de execução estratégica, Catalent e Andy Goll, diretor de operações da Weiler Engineering, Inc.
Desde o desenvolvimento de soluções intravenosas, uma prática padrão tem sido usar vidro para embalagem. O que esperar do vidro, e especificamente o que controlar, tem sido bem documentado e estudado, o que o torna um produto confiável na indústria biofarmacêutica. No entanto, uma quantidade significativa de intervenção humana é necessária no preenchimento tradicional de garrafas de vidro, o que pode levar a vários problemas, como a contaminação.
À medida que a indústria continua seu movimento em direção aos produtos biológicos, serão necessárias soluções e tecnologias inovadoras para garantir uma abordagem segura e confiável para a fabricação e entrega desses medicamentos. Uma opção é alavancar a fabricação asséptica avançada da tecnologia blow-fill-seal (B / F / S). Para entender por que o B / F / S é uma ótima opção a ser considerada nas condições atuais do mercado, é importante primeiro entender como o B / F / S funciona.
Os cinco passos de B / F / S
O contêiner AB / F / S é criado usando um processo de fabricação contínuo e automatizado. Em questão de segundos, um recipiente B / F / S pode ser formado, preenchido e vedado em condições assépticas ISO 5 (Classe A) dentro da máquina B / F / S. Esta tecnologia reduz drasticamente o risco de partículas estranhas e contaminação microbiana em um processo de fabricação altamente eficiente.
As cinco etapas básicas do processo são:
- Extrusão - Uma resina termoplástica, que forma o frasco ou recipiente, é derretida sob uma temperatura muito alta. O processo força uma transição de fase de sólido para líquido e forma tubos de plástico chamados de paródia.
- Formação de contêineres - O parison é então lavado com ar estéril antes de ser cortado. Quando o parison atinge o comprimento adequado, um molde de dois estágios se fecha em torno dele. O molde principal e as mandíbulas mantêm-se fechadas, comprimindo a parte inferior do parison para formar o corpo do recipiente, mantendo o topo aberto.
- Preenchimento - O molde então segue em direção à zona de preenchimento da Classe A, onde os bicos de abastecimento são abaixados para dentro do contêiner. Em seguida, é preenchido com 0,2 ml a 1000 ml de solução contendo medicamento. O bocal é então levantado e, através de tubos de aspiração, pode ser inserido automaticamente um tampão de borracha no topo do frasco enquanto este ainda estiver aberto.
- Selo - Neste estágio, o molde se fecha para formar o topo, o que hermeticamente fecha o recipiente e, nesta aplicação, a vedação na inserção da rolha de borracha.
- Liberação - O molde abre e o recipiente formado, preenchido e vedado é transportado para fora da máquina.
O processo B / F / S elimina a intervenção humana, o que reduz consideravelmente o risco de contaminação típico do enchimento tradicional de garrafas de vidro.
Os benefícios da capacidade da B / F / S de reduzir a contaminação e fornecer outra opção para aplicações de embalagens primárias são de grande alcance. Os maiores desafios com embalagens de vidro podem ser resolvidos com B / F / S, mitigando assim os riscos tipicamente associados ao envase asséptico e fabricação asséptica.
Examinando as rachaduras no uso de embalagens de vidro
Existem várias desvantagens no uso de vidro para embalagens que tornam o B / F / S uma alternativa viável para os fabricantes de biofarma:
- Partículas - Este é, de longe, o maior problema enfrentado atualmente pelas embalagens de vidro. Partículas do meio ambiente e / ou delaminação do vidro podem apresentar sérios riscos se administradas por via intravenosa a um paciente. Em 2016, houve 13 recalls relacionados à presença de partículas. 1 Como resultado de drogas sendo mantidas no mercado durante um recall, a indústria também enfrenta uma possível escassez de medicamentos caso a questão das partículas continue. Esse aumento no número de recalls (e, em última análise, a escassez de medicamentos) chamou a atenção de toda a indústria, levando a um foco maior em como reduzir o potencial de contaminação em produtos biológicos. Através da automação e simplificação do processo, o B / F / S tem o potencial de reduzir significativamente a presença de partículas.
- Riscos de esterilidade - Os métodos manuais para embalagens de vidro criam um risco maior de contaminação microbiana. Com um processo B / F / S automatizado que leva apenas 15 segundos, o B / F / S reduz drasticamente esse risco, pois o contêiner fica aberto por apenas alguns segundos antes do enchimento e da vedação do produto.
- Quebra - Como acontece com qualquer coisa feita de vidro, a embalagem tradicional tem maior probabilidade de quebra. Isso pode acontecer durante o processo de embalagem, envio e até durante o uso. Os fragmentos de vidro podem representar um perigo para os funcionários e potencialmente pacientes. Também pode afetar a produtividade, se for necessário tempo de inatividade prolongado para a limpeza.
- Falta de flexibilidade - A embalagem de vidro é geralmente garrafas, o que limita o fabricante a um design cilíndrico. Com B / F / S, uma empresa farmacêutica tem mais opções sobre como eles querem entregar a medicação ao paciente. Um contêiner pode ter qualquer formato, tornando as embalagens mais eficientes e o peso do carregamento mais leve. Isso tem o potencial de facilitar a distribuição global de produtos biológicos, como as vacinas. Em última análise, B / F / S fornece liberdade de design primário recipiente.
Apesar dos benefícios da B / F / S em relação ao vidro, há algumas considerações críticas que um fabricante deve fazer antes de começar a utilizar embalagens plásticas para seu produto biológico.
Provando Compatibilidade Para Formulações De Grandes Moléculas
A determinação da embalagem apropriada para uma formulação de molécula grande é especialmente desafiadora devido à necessidade crítica de manter a estabilidade da proteína durante todo o processo de fabricação. Se houver algum dano estrutural à proteína por sua embalagem primária, isso pode afetar a resposta imunogênica do paciente e, como resultado, a eficácia da droga. É por isso que é imperativo realizar testes de estabilidade antes de selecionar um material de embalagem.
Embora a embalagem plástica seja diferente e apresente um risco de diferentes lixiviáveis e extraíveis, esse não é o caso de todos os plásticos disponíveis. Além disso, todos os materiais possuem itens extraíveis. O vidro e até o aço têm itens extraíveis que podem afetar negativamente um medicamento. No entanto, devido à história, esses produtos foram bem caracterizados e a indústria está confortável com os riscos que apresentam. Para determinar os riscos que sua embalagem apresenta - independentemente de se tratar de plástico - a estabilidade deve ser testada para determinar a compatibilidade entre o produto e a embalagem. Para fazer isso, o produto deve ser armazenado na embalagem selecionada por um longo período de tempo. Uma análise química é concluída no final do prazo designado para determinar se o produto foi degradado e qual, se houver, o impacto é dos lixiviáveis.
O teste de estabilidade também deve testar a permeação, outra preocupação relacionada às embalagens plásticas. Ao contrário do vidro, que é impermeável, os plásticos são considerados semipermeáveis. Isso não quer dizer que a permeação tenha um impacto negativo na molécula. No geral, a permeação depende de muitos fatores, como o material, a espessura e até mesmo as condições de temperatura às quais o produto é exposto durante a embalagem. O teste de estabilidade permite que uma empresa determine os parâmetros críticos de controle para cada um desses fatores - lixiviáveis e extraíveis, permeação e estabilidade térmica - para garantir a segurança e a eficácia.
Colocando B / F / S para o teste
B / F / S tem sido usado para um medicamento biológico comercial para o mercado de inalação por mais de 20 anos, e também foi testado com sucesso para vários produtos biológicos. No entanto, a Catalent, um dos principais CDMO na indústria de ciências da vida, queria comparar os conjuntos de dados entre o vidro e um frasco B / F / S, ADVASEPT®, para embalar um medicamento de molécula grande. A ADVASEPT Technology é a solução avançada de envase asséptico da Catalent para produtos parenterais que utiliza o processo B / F / S. Aproveitando as instalações biológicas da empresa, a Catalent formulou um anticorpo monoclonal (mAb) e, em seguida, conduziu um estudo de compatibilidade de 24 meses usando o mesmo mAb preenchido em frascos de vidro tradicionais e frascos ADVASEPT.
O estudo de compatibilidade foi composto por 17 testes analíticos diferentes ao longo de uma série de pontos de tempo (3 meses, 6 meses, 9 meses, 12 meses, 24 meses). Esses testes incluíram SDS Page, mapeamento de proteínas e atividade celular. Os dados do estudo de estabilidade concluíram que o anticorpo monoclonal era comparável em frascos de vidro e ADVASEPT. As tabelas a seguir foram apresentadas pelo Dr. Gregory Bleck no Encontro Americano da Associação Internacional de Operadores de 2015 da BFS (IOA) em Seattle. Eles mostram um exemplo desses resultados demonstrando a comparabilidade do mAb nos dois frascos diferentes:
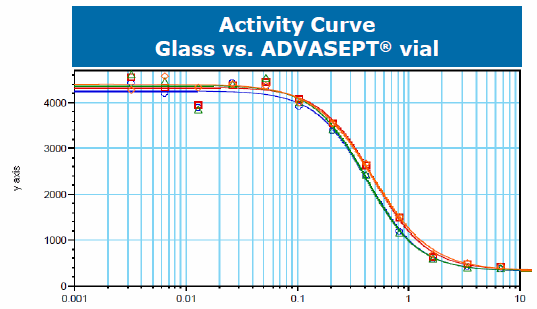
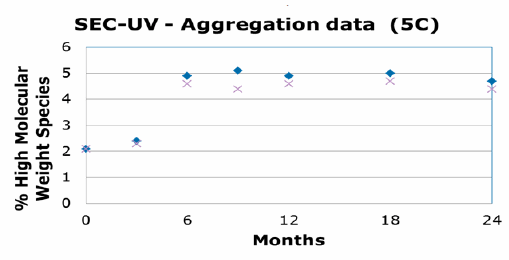

É difícil extrapolar dados para moléculas grandes por causa das respostas variadas que podem ter; entretanto, esses testes indicam que a tecnologia B / F / S é uma opção viável para a embalagem primária de produtos biológicos. O B / F / S oferece não apenas um processo de fabricação eficiente, mas também um método de entrega de dose unitária de baixo custo. Essas características são críticas em um setor em que a inovação e a tecnologia serão necessárias para enfrentar os desafios do envase de vidro tradicional, bem como a distribuição global de produtos biológicos.
- Administração de Alimentos e Medicamentos dos EUA, 2016 Alertas de Segurança para Produtos Médicos Humanos - https://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm479348.htm
Sobre a Weiler Engineering, Inc.
Weiler Engineering, Inc. fornece tecnologia avançada de processamento de líquido asséptico através da aplicação de personalização ASEP-TECH ® sopro / Fill / máquinas Seal e serviços integrados de desenvolvimento para aplicações específicas do cliente. Desde 1959, a empresa trouxe inovação em design, desenvolvimento, tecnologia, validação e ciência regulatória para cada projeto. A Weiler está comprometida com os mais altos padrões de excelência e expandindo ainda mais seus produtos e sistemas para melhorar o atendimento ao paciente. www.weilerengineering.com
Sobre a Catalent
A Catalent é o parceiro número 1 em tecnologia avançada de entrega e soluções de desenvolvimento para medicamentos, produtos biológicos e produtos de saúde para o consumidor. Com mais de 80 anos atendendo à indústria, a Catalent tem experiência comprovada e o mais amplo portfólio de tecnologias superiores para trazer mais produtos ao cliente mais rapidamente, aprimorar o desempenho do produto e garantir o fornecimento confiável de produtos clínicos e comerciais. Nossa equipe de mais de 10.000 pessoas, localizada em mais de 30 locais nos cinco continentes, produz mais de 70 bilhões de doses de mais de 7.000 produtos para mais de 1.000 clientes. Nossa paixão é ajudar a liberar todo o potencial do seu produto. www.catalent.com
Nenhum comentário:
Postar um comentário